In Laboratorien und in der chemischen Industrie ist es sehr wichtig, die Menge der an den Reaktionen beteiligten Substanzen zu kennen. Daher werden wir uns im Folgenden mit den wichtigsten Konzepten, Größen und Maßeinheiten in Bezug auf die Massen von Atomen befassen:
- Atommasseneinheit (u):
Das Standardgewichtsreferenzatom zur Bezeichnung der atomaren Masseneinheit ist Kohlenstoff-12 (12). Eine atomare Masseneinheit (1 u) entspricht dem Wert von 1.66054. 10-24 g, das ist die Masse von 1/12 des Kohlenstoffisotops mit einer Masse gleich 12 (12).
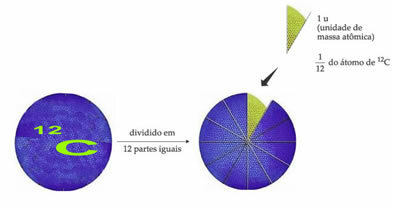
Die atomare Masseneinheit (u) ist die Einheit, die in allen unten aufgeführten Mengen verwendet wird.
- Atommasse eines Atoms oder Isotops (MA):
Er wird durch Vergleich mit dem im vorherigen Punkt erwähnten Referenzwert ermittelt. Zum Beispiel die Atommasse von 919F wird durch das Massenspektrometer angegeben, das 18,9984 u entspricht. Aufgerundet ergibt es 19, was dem Wert seiner Massenzahl (A) entspricht. Dieser Wert bedeutet, dass die Atommasse des Elements 919F ist 19-mal größer als die Masse von 1/12 des 12.
- Atommasse eines Elements (AM):
Die Atommasse des Elements wird durch das gewichtete Mittel der Atommassen seiner Isotope bestimmt. Dies geschieht durch Multiplizieren der Atommassen jedes Isotops mit dem Prozentsatz, der in der Konstitution des Elements vorkommt. Diese Werte werden dann addiert, die durch 100 geteilt werden, was den Gesamtprozentsatz ergibt.
Das Element Neon besteht beispielsweise aus drei Isotopen mit folgenden Atommassen und Prozentsätzen in ihrer Konstitution:

Berechnung der Atommasse (MA) dieses Elements:
SCHLECHTNeon- = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
SCHLECHTNeon- = 20.179 US-Dollar
- Molekulargewicht (MM):
Wie der Name schon sagt, wird es für molekulare Substanzen verwendet, dh Atome, die durch die gemeinsame Nutzung von Elektronenpaaren verbunden sind, die als kovalente Bindungen bezeichnet werden.
Die Molekülmasse wird erhalten, indem die Anzahl der Atome jedes Elements mit ihren Atommassen multipliziert und die Ergebnisse addiert werden.
Zum Beispiel das CO-Molekül2 enthält einen Kohlenstoff und zwei Sauerstoff, also multiplizieren wir die Atommasse von Kohlenstoff mit 1; und Sauerstoff um zwei, später hinzufügen:
MMCO2 = (1. SCHLECHTÇ) + (2. SCHLECHTÖ)
MMCO2 = (1. 12) + (2. 16)
MMCO2 = 12 + 32
MMCO2 = 44 u
- Masse-Formel:
Es ist die gleiche Berechnung, die für die Molekülmasse durchgeführt wird, jedoch für ionische Verbindungen. In diesem Fall ist der Name anders, weil sie nicht in Moleküle, sondern in Ionencluster gruppiert sind. Da es keine Moleküle gibt, macht es offensichtlich keinen Sinn, von Molekülmasse zu sprechen, aber die Berechnungsgrundlage ist dieselbe.
Beispiel:
NaCl
↓ ↓
23 +35,5 → Formelmasse = 58,5 u
Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm