Aluminium wird durch metallurgische Verfahren gewonnen. Metallurgie ist ein Gebiet, das die Umwandlung von Erzen in Metalle oder metallische Legierungen untersucht. Durch dieses Verfahren werden mehrere Metalle wie Kupfer, Titan, Eisen und Mangan gewonnen.
Bei Aluminium wird hauptsächlich das Erz verwendet Bauxit (Abbildung), das Aluminiumoxidhydrat (Aℓ2Ö3. x H2O) und verschiedene Verunreinigungen.

In der Aluminiummetallurgie laufen die folgenden vier Schritte ab:
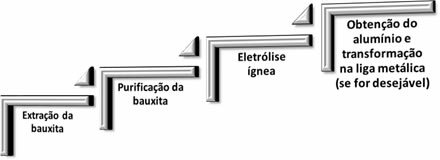
Wenn Aluminiumoxid (Aℓ2Ö3(s)) wird von Bauxit getrennt, sein Name wird zu Aluminiumoxid.
Zuvor wurde Folgendes durchgeführt: Aluminiumoxid wurde mit Salzsäure behandelt, um Aluminiumchlorid zu erzeugen; die zur Reaktion mit metallischem Kalium oder Natrium gebracht wurde, wodurch die Verbindung reduziert und metallisches Aluminium entsteht:
Aℓ2Ö3(s) + 6 HCℓ(Hier)→ 4 AℓCℓ3 (wässrig) + 3 H2Ö(ℓ)
ACℓ3 (wässrig) + 3K(s)→ 3 KCℓ(s) + Aℓ(s)
Diese Methode war jedoch sehr teuer und ineffizient, sodass Aluminium als seltenes Metall galt.
Aber im Jahr 1886 entwickelten zwei Wissenschaftler separat die oben erwähnte Methode, bei der die magmatische Elektrolyse verwendet wurde. Diese Wissenschaftler waren der Amerikaner Charles M. Hall und dem Franzosen Paul Héroult, deshalb wurde diese Methode genannt
Hall-Heroult-Prozess oder einfach,Hallenprozess, während Charles M. Hall hat es patentieren lassen.Der entscheidende Punkt, den sie entdeckten, war, wie man Aluminiumoxid dazu flüssig macht. in der Lage sein, seine magmatische Elektrolyse durchzuführen, da das Problem darin bestand, dass sein Schmelzpunkt höher war 2000 °C. Sie verwendeten ein Flussmittel, Kryolitherz (Na3AℓF6), wodurch die Schmelztemperatur von Aluminiumoxid auf etwa 1000 °C gesenkt werden konnte.
So wurde diese Mischung aus Aluminiumoxid und Kryolith, wie im Diagramm unten gezeigt, in einen mit Kohlenstoff ausgekleideten Elektrolysebehälter aus Stahl gegeben. Durch dieses geschmolzene Gemisch fließt ein elektrischer Strom. Die mit der Mischung in Kontakt stehenden Wände des Behälters wirken als negativer Pol der Elektrolyse (Kathode), wo die Reduktion von Aluminiumkationen stattfindet. Die Anode (Pluspol) sind Zylinder aus Graphit oder Kohlenstoff, also beide aus Kohlenstoff, in denen die Oxidation von Sauerstoffanionen stattfindet:
Kathodenhalbreaktion: 4 Aℓ3+(ℓ) + 12 und- → 4 Aℓ(ℓ)
Anodenhalbreaktion: 6 O2-(ℓ) → 12 und- + 3 O2(g)
Der gebildete Sauerstoff reagiert in der Anode mit Kohlenstoff und erzeugt ebenfalls Kohlendioxid:
3 O2(g) + 3 C(s) → 3 CO2(g)
Die Gesamtreaktion und das Schema dieser magmatischen Elektrolyse, die zu Aluminium führt, sind also gegeben durch:

Das erhaltene Aluminium liegt in flüssiger Form vor, da sein Schmelzpunkt mit 660,37 °C niedriger ist als der einer Mischung aus Aluminiumoxid und Kryolith. Aluminium ist auch dichter als die Mischung und wird daher am Boden des Behälters abgelagert, wo es gesammelt wird.
Bei der Herstellung von 1 Tonne Aluminium wird es verwendet:
- 4 bis 5 Tonnen Bauxit, woher? 2 Tonnen Aluminiumoxid;
- 50 Kilogramm Kryolith (es gibt nicht viele natürliche Reserven an Kryolith, daher wird es normalerweise durch seine Synthese aus Fluorit (CaF2), ein in der Natur am häufigsten vorkommendes Mineral);
- 0,6 Tonnen Kohle für die Elektroden.
Die jährliche Aluminiumproduktion übersteigt exceed 27,4 Millionen Tonnen.
Unter den wichtigsten Aluminiumlegierungen haben wir die folgenden:

Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/obtencao-aluminio-por-meio-eletrolise.htm
