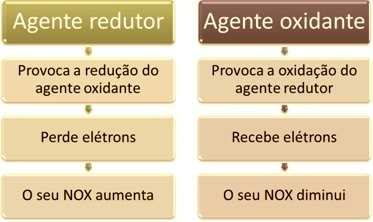
Eines der Hauptmerkmale, die eine Oxidations-Reduktions-Reaktion (oder Redox) der anderen ist das Vorhandensein eines Oxidationsmittels und eines Reduktionsmittels, die wie folgt definiert werden können:
Sehen Sie sich zum Beispiel die folgende chemische Reaktion an, bei der Aluminium (Al) in wässriger Salzsäure (HCl) korrodiert. Aluminiumatome übertragen Elektronen auf H-Kationen+(Hier) und erzeugen das Al-Kation3+(Hier):
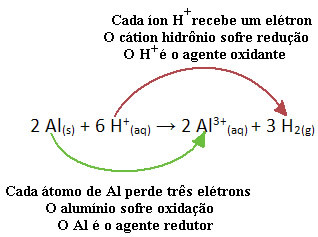
Beachten Sie, dass, da Al Elektronen übertragen hat, dies bedeutet, dass er hat die Reduzierung verursacht der H-Kationen+(Hier); deshalb heißt er Reduktionsmittel. Schon das Kation H+(Hier) die Elektronen aus dem Aluminium entfernt, Oxidation verursachen dieses Metalls; deshalb handelt er als a Oxidationsmittel.
Im Alltag gibt es viele Beispiele für die Leistungsfähigkeit von Oxidations- und Reduktionsmitteln. Betrachten Sie einige von ihnen und denken Sie daran, dass in allen Fällen die Reduktion gleichzeitig mit der Oxidation erfolgt; daher gibt es, wenn ein Reduktionsmittel vorhanden ist, auch ein Oxidationsmittel.
- Beispiele für Reduktionsmittel:
- Bei fotografischen Filmen: photographische Filme enthalten lichtempfindliche Silbersalze. An Stellen mit Lichteinfall kommt es zu einer Reduktion von Ag-Ionen+, was zu dem bei den Negativen beobachteten Kontrast führt.

- Vitamin C: Vitamin C (L-Ascorbinsäure) ist ein starkes Reduktionsmittel in wässriger Lösung. Es hat eine außergewöhnliche Fähigkeit, oxidiert zu werden, und wird daher häufig verwendet, insbesondere in Lebensmitteln wie z Antioxidans, d.h. es wird anderen Lebensmitteln zugesetzt und schützt diese aufgrund seiner eigenen Wirkung vor möglicher Oxidation Opfern. Ein Beispiel sind Früchte wie Äpfel und Birnen, die bei Kontakt mit Luftsauerstoff dunkel werden, weil sie oxidieren. Aber wenn Sie den Früchten eine kleine Menge Orangen- oder Zitronensaft (die Vitamin C enthalten) hinzufügen geschnitten, verhindert dies diese Reaktion, da Vitamin C als Reduktionsmittel wirkt und vor der Frucht oxidiert.

- Wasserstoffgas: das Wasserstoffgas (H2) wird im Raketenantrieb eingesetzt und gilt als eine der wichtigsten Energiealternativen, da bei der Verbrennung viel Energie und keine Schadstoffe freigesetzt werden. Bei dieser Reaktion wirkt Wasserstoff als Reduktionsmittel, der durch Sauerstoff oxidiert wird.
- Beispiele für Oxidationsmittel:
- Bei der Essigherstellung: Wenn Wein der Luft ausgesetzt wird, wird er zu Essig, dessen Hauptbestandteil Essigsäure ist. Denn der im Wein vorhandene Ethylalkohol bzw. Ethanol oxidiert bei Kontakt mit Luftsauerstoff zu Essigsäure. Sauerstoff ist somit ein Oxidationsmittel. Schon der Ursprung des Begriffs „Oxidation“ hängt mit der Reaktion mit Sauerstoff zusammen.

- Im Rost: wie im vorherigen Beispiel angegeben, wirkt Sauerstoff als Oxidationsmittel für Alkohol; Dies geschieht auch in Kontakt mit verschiedenen Metallen, wie z. B. Eisen, die den Rostprozess verursachen. Als Oxidationsmittel kommen hier neben dem Luftsauerstoff Wasser oder eine saure Lösung in Frage.
- Bei Bleichmitteln: die Bleichwirkung der Bleichmittel beruht auf der Anwesenheit der folgenden zwei Reduktionsmittel: o Hypochloritanion (im Allgemeinen in Form von Natriumsalz – NaOCl), das beispielsweise in Bleichmitteln vorhanden ist; und Wasserstoffperoxid (H2Ö2), das als Wasserstoffperoxid vermarktet wird. Diese beiden Verbindungen neigen sehr stark zur Oxidation und bewirken die Reduktion anderer chemischer Spezies. Daher sind sie für oxidierende Substanzen verantwortlich, die Produkten eine dunkle Farbe verleihen. In Zellulose wird beispielsweise Lignin abgebaut und wird leichter und formbarer. Bei der Fleckenentfernung und Textilbleiche bewirken diese Oxidationsmittel die Oxidation organischer Moleküle wie Fette und Farbstoffe.

- Bei Alkoholtestern: ein einfacher Einweg-Atemanalysegerät besteht aus einem klaren Röhrchen, das eine wässrige Lösung des Dichromatsalzes von Kalium und Kieselsäure enthält, die mit Schwefelsäure angefeuchtet ist; gemischt mit oranger Farbe. Dieses Salz reagiert in Kontakt mit dem im Atem des betrunkenen Fahrers enthaltenen Alkoholdampf und verfärbt sich grün. Dies bedeutet, dass die Oxidation von Ethanol (Alkohol) zu Ethanal verursacht wird.

Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/conceito-exemplos-agente-redutor-agente-oxidante.htm

