Als Polarität wird die Fähigkeit der Verbindungen bezeichnet, elektrische Ladungen anzuziehen, die je nach vorhandener Verbindung einen anderen Charakter annimmt.
Die häufigsten Bindungen organischer Verbindungen finden zwischen Kohlenstoffatomen oder zwischen Kohlenstoff- und Wasserstoffatomen statt: C C und C ─ H (Kohlenwasserstoffe). Wir klassifizieren diese Art von Bindung als kovalent, sie ist in allen Bindungen organischer Verbindungen vorhanden, die nur aus Kohlenstoff und Wasserstoff bestehen.
Wenn sich im Molekül einer organischen Verbindung neben Kohlenstoff und Wasserstoff noch ein anderes chemisches Element befindet, haben seine Moleküle eine bestimmte Polarität. Wir nennen dieses Element ein Heteroatom und es kann sein: Stickstoff (N), Sauerstoff (O), unter anderem.
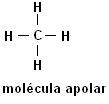
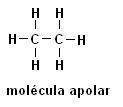
Methan (CH4) Ethan (C2H6)
Beachten Sie, dass in beiden Strukturen keine Heteroatome vorhanden sind, in diesem Fall werden die Moleküle als unpolar klassifiziert.


Das Vorhandensein von Sauerstoff als Heteroatom führt dazu, dass die Moleküle Polarität zeigen. Das erste Molekül ist die Verbindung Ethanol (
CH3CH2Oh), verleiht die Anwesenheit von Hydroxyl – OH dieser Verbindung einen polaren Charakter, auch wenn sie in ihrer Struktur einen unpolaren Teil enthält.Von Líria Alves
Abschluss in Chemie
Brasilianisches Schulteam
Mehr sehen! flaches Isomer
Organische Chemie - Chemie - Brasilien Schule
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm
