DAS Batterie ist ein System, in dem die Oxidations-Reduktions-Reaktion stattfindet. In diesem Gerät wird die bei der spontanen Reaktion entstehende chemische Energie in elektrische Energie umgewandelt.
Oxidations- und Reduktionsreaktionen laufen gleichzeitig in einer Zelle ab. Wenn eine Spezies oxidiert wird, gibt sie Elektronen an die andere Spezies ab, die, nachdem sie sie erhalten hat, einer Reduktion unterzogen wird.
Daher ist derjenige, der einer Oxidation unterzogen wird, das Reduktionsmittel und derjenige, der einer Reduktion unterzogen wird, das Oxidationsmittel.
DAS Oxidation tritt auf, wenn eine Spezies Elektronen verliert und zu einem Kation wird: A → A+ + und-.
DAS die Ermäßigung tritt auf, wenn eine Spezies Elektronen aufnimmt und elektrisch neutral wird: B+ + und- → B.
In den chemischen Gleichungen ist dies Elektronentransfer zeigt sich an der Änderung der Oxidationszahl (nox).
In den Zellen finden Reduktionsreaktionen statt und der elektrische Strom entsteht durch die Wanderung von Elektronen vom Minus- zum Pluspol.

Wie funktioniert ein Stack?
Einer redox Reaktion kann allgemein durch die Gleichung dargestellt werden:
A+B+ → A+ +B
Wo,
A: Stoff, der oxidiert wird, Elektronen verliert, seinen Wert erhöht und das Reduktionsmittel ist.
B: Substanz, die einer Reduktion unterliegt, Elektronen aufnimmt, die Oxidation verringert und das Oxidationsmittel ist.
Sehen Sie im folgenden Bild, wie dieser Prozess dargestellt werden kann.
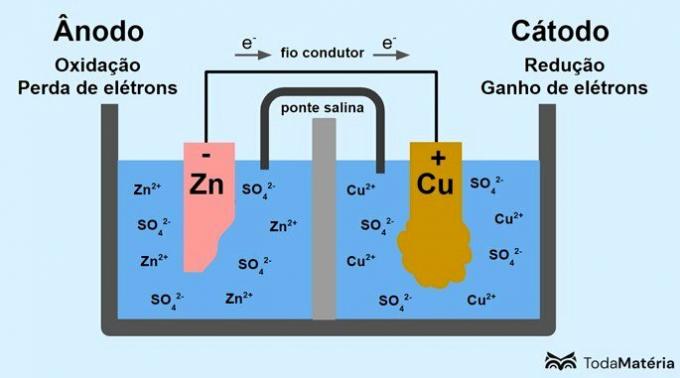
Das in zwei Halbzellen unterteilte System, das aus zwei metallischen Elektroden besteht, die extern durch einen leitenden Draht verbunden sind, wurde 1836 von John Frederic Daniell (1790-1845) entwickelt.
Die Batterie besteht aus zwei Elektroden, die durch einen leitenden Draht verbunden sind, und einem Elektrolyten, in dem sich die Ionen befinden. Die Elektrode ist die feste leitende Oberfläche, die den Austausch von Elektronen ermöglicht.
Anode: Elektrode, an der Oxidation stattfindet. Es ist auch der Minuspol der Batterie.
Kathode: Elektrode, an der Reduktion auftritt. Es ist auch der Pluspol der Batterie.
In der Abbildung oben ist metallisches Zink die Anode und wird der Anode unterzogen Oxidation. Metallisches Kupfer ist die Kathode und wird reduziert. Die Wanderung von Elektronen (e-) erfolgt von der Anode zur Kathode durch den leitfähigen Draht.
Die im Bildsystem auftretenden Reaktionen sind:
- Anode (Oxidation): Zn(s) → Zn2(hier) + 2e-
- Kathode (Reduktion): Cu2+(hier) + 2e- → ass(s)
- allgemeine Gleichung: Zn(s) + Arsch2+(hier) → ass(s) + Zn2+(hier)
Zink ist ein Metall mit einer größeren Tendenz, Elektronen abzugeben, und daher werden in der Lösung Kationen gebildet. Die Zinkelektrode beginnt sich abzunutzen und an Masse zu verlieren, weil Zink bei der Bildung von Zn-Kationen in Lösung freigesetzt wird2+.
Die Elektronen von der Anode kommen an der Kathode an und die Metallkationen werden bei ihrem Empfang in metallisches Kupfer umgewandelt, das sich auf der Elektrode ablagert und ihre Masse erhöht.
Die Salzbrücke ist ein Ionenstrom, der für die Zirkulation von Ionen im System verantwortlich ist, um es elektrisch neutral zu halten.
Lesen Sie auch über Oxidationszahl (nox).
Batterietypen
In einer Zelle wird die Tendenz chemischer Spezies, Elektronen aufzunehmen oder abzugeben, durch das Reduktionspotential bestimmt.
Die Komponente mit dem höchsten Reduktionspotential neigt zur Reduktion, dh zur Aufnahme von Elektronen. Die Spezies mit dem niedrigsten Reduktionspotential und folglich dem höchsten Oxidationspotential neigt dazu, Elektronen zu übertragen.
Beispielsweise bei der Redoxreaktion Zn0(s) + Arsch2+(hier) → ass0(s) + Zn2+(hier)
Zink oxidiert und gibt Elektronen ab, weil es ein Reduktionspotential E hat0 = -0,76 V, weniger als das Reduktionspotential von Kupfer E0 = +0,34 V und nimmt daher Elektronen auf und erfährt eine Reduktion.
Siehe unten für weitere Beispiele von Stacks.
Zink- und Wasserstoffstapel
Oxidationshalbreaktion: Zn(s) → Zn2+ + 2e- (UND0 = -0,76 V)
Reduktionshalbreaktion: 2H+(hier) + 2e- → h2(g) (UND0 =0,00 V)
Globale Gleichung: Zn(s) + 2 Std+(hier) → Zn2+(hier) +H2(g)
Stapeldarstellung:
Kupfer- und Wasserstoffzelle
Oxidationshalbreaktion: H2(g) → 2 Std+(hier) + 2e- (UND0 = 0,00 V)
Reduktionshalbreaktion: Cu2+(hier) + 2e- → ass(s) (UND0 = +0,34 V)
Globale Gleichung: Cu2+(hier) +H2(g) → 2 Std+(hier) + Arsch(s)
Stapeldarstellung:
Holen Sie sich mehr Wissen zum Thema mit den Inhalten:
- Elektrochemie
- Elektrolyse
Bibliographische Referenzen
FONSECA, M. R. M. Chemie, 2. 1. ed. São Paulo: Attika, 2013.
SANTOS, WLP; MOL, G.S. Bürgerchemie, 3. 2. ed. São Paulo: Editora AJS, 2013.
USBERCO, J. Chemie verbinden, 2: Chemie. - 2. ed. São Paulo: Saraiva, 2014.


