Im Alltag und im Labor gibt es spontane und nicht spontane Reaktionen und Transformationen. Zum Beispiel ist jede Verbrennung eine spontane Reaktion, denn einmal begonnen, wird sie fortgesetzt, bis der gesamte Kraftstoff verbraucht ist oder bis der gesamte Sauerstoff aufgebraucht ist.
Andererseits ist die Elektrolyse ein nicht-spontaner Prozess, bei dem elektrische Energie in chemische Energie umgewandelt wird. Ein Beispiel ist die Elektrolyse von Natriumchlorid (NaCl). Wenn elektrischer Strom über diese Salzschmelze geleitet wird, kommt es zu Redoxreaktionen und zur Bildung von metallischem Natrium (Na(s)) und Chlorgas (Cl2(g)). Wenn wir aufhören, den elektrischen Strom zu leiten, wird die Reaktion nicht von selbst weitergehen, was zeigt, dass sie nicht spontan ist.
Die Spontaneität einer Reaktion lässt sich mit dem Gibbs-Helmholtz-Gleichung, unten angegeben:

Auf was:
∆G = Variation der freien Energie;
∆H = Enthalpieänderung;
T = Temperatur in Kelvin (immer positiv);
∆S = Entropieänderung.
Diese Gleichung hat ihren Namen, weil sie vom amerikanischen Physiker J. Willard Gibbs (1839-1903) und des deutschen Physikers Hermann Helmholtz (1821-1894).
Um besser zu verstehen, wie diese Gleichung uns hilft, die Spontaneität einer Reaktion zu bestimmen, lassen Sie uns kurz jedes der daran beteiligten Konzepte betrachten:
- ∆H (Enthalpievariation): Die Enthalpie (H) ist der Energieinhalt eines Stoffes. Bisher ist keine Möglichkeit bekannt, dies zu bestimmen. In der Praxis wird erreicht, dass die Enthalpievariation (∆H) eines Prozesses mit Hilfe von Kalorimetern gemessen wird. Diese Variation ist die Menge von Energie, die dabei freigesetzt oder aufgenommen wurde.
- ∆S (Entropievariation):Entropie (S) ist die thermodynamische Größe, die den Grad der Unordnung in einem System misst.
Beim Schmelzen von Eis beispielsweise bewegen sich Moleküle von einem festen in einen flüssigen Zustand, in dem eine größere Desorganisation stattfindet. Das bedeutet, dass bei diesem Vorgang die Entropie zugenommen hat (∆S > 0).
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
Bei der Herstellung von Ammoniak (NH3), reagiert 1 Mol Stickstoffgas mit 3 Mol Wasserstoffgas (d. h. 4 Mol Moleküle in den Reaktanten), wodurch 2 Mol Ammoniak entstehen:
Nein2(g) +3 H2(g) → 2 NH3(g)
Da dabei die Anzahl der Moleküle in der Gasphase abnimmt, nimmt die Desorganisation ab, was bedeutet, dass auch die Entropie abnimmt (
Ein System hat globale Energie, aber nur ein Bruchteil dieser Energie wird verwendet, um Arbeit zu verrichten, dies wird als Gibbs-freie Energie bezeichnet, symbolisiert durch G.
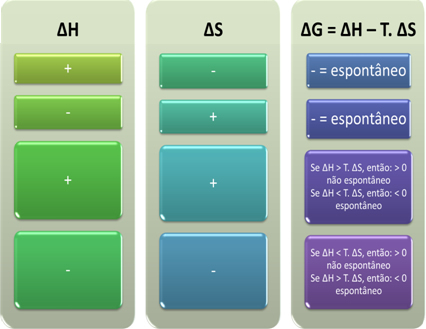
Laut Gibbs, ein Prozess gilt als spontan, wenn er Arbeit verrichtet, d. h. wenn G abnimmt. In diesem Fall ist der Endzustand der Transformation stabiler als der Anfangszustand, wenn ∆G < 0 ist.
Daraus können wir folgendes schließen:

Wir können auch sehen, ob ein Prozess spontan ist, indem wir das Vorzeichen von ∆H und ∆S in der Gibbs-Helmholtz-Gleichung betrachten:
Von Jennifer Fogaça
Abschluss in Chemie
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
FOGAÇA, Jennifer Rocha Vargas. "Freie Gibbs-Energie"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/quimica/energia-livre-gibbs.htm. Zugriff am 28. Juni 2021.