DAS Nihonium, Ordnungszahl 113 und Symbol Nh, ist ein chemisches Element, das zur Gruppe 13 des Periodensystems gehört. Darüber hinaus ist es ein superschweres Element, das in der Natur nicht vorkommt. Daher kann seine Gewinnung nur künstlich durch Kernfusionsreaktionen erfolgen. Die chemischen Eigenschaften von Nihonium sind noch unklar, aber es wird spekuliert, dass es sich in einigen Fällen ähnlich wie sein leichteres Gegenstück, Thallium, verhält.
Nihonium wurde zunächst durch Schmelzen gewonnen 70Zn mit der 209Bi, am Riken Institute, Japan, im Jahr 2003. Obwohl auch russische und amerikanische Wissenschaftler darum baten, als Entdecker von Element 113 anerkannt zu werden, erkannte die IUPAC die japanischen Wissenschaftler an. Der Name bezieht sich auf das Wort Nihon, wie die Japaner ihr Heimatland nennen.
Lesen Sie auch: Gallium – ein weiteres chemisches Element, das zur Gruppe 13 des Periodensystems gehört
Themen in diesem Artikel
- 1 - Zusammenfassung über Nihonium
- 2 - Eigenschaften von Nihonium
- 3 - Eigenschaften von Nihonium
- 4 - Erhalt des Nihoniums
- 5 - Geschichte von Nihônio
- 6 - Gelöste Übungen zu Nihonium
Zusammenfassung über Nihonium
Es ist ein synthetisches chemisches Element der Gruppe 13 der Periodensystem.
Seine Produktion begann 2003 am Riken Institute, Japan.
Es bildet die Gruppe der Elemente, die zuletzt 2015 in das Periodensystem aufgenommen wurden.
Seine Studien sind noch sehr neu, aber einige versuchen, sie mit anderen Elementen der Gruppe 13 wie Thallium in Verbindung zu bringen.
Seine Produktion ist Kernfusion, unter Verwendung von Isotopen von 70Zn und Atome von 209Bi.
Hör jetzt nicht auf... Nach der Anzeige gibt es mehr ;)
Eigenschaften von Nihonium
Symbol: nö
Ordnungszahl: 113
Atommasse: zwischen 278 und 286 cu (inoffiziell von Iupac)
Elektronische Konfiguration: [Rn] 7s2 5f14 6d10 19 Uhr1
Stabilstes Isotop:286Nh (9,5 Sekunden von Halbwertzeit, die sich um 6,3 Sekunden erhöhen oder um 2,7 Sekunden verringern kann)
Chemische Reihe: Gruppe 13, superschwere Elemente
Eigenschaften von Nihonium
Nihonium, Symbol Nh und Ordnungszahl 113, war eines der letzten Elemente im Periodensystem. Seine offizielle Verabschiedung erfolgte am 30. Dezember 2015 durch die International Union of Pure and Applied Chemistry (IUPAC), während sein Name erst Mitte 2016 offiziell gemacht wurde.
Elemente in dieser Region des Periodensystems sind sehr instabil, was bedeutet, dass sie in der Natur nicht vorkommen. Angesichts einer angeblichen Existenz würden sie also fast augenblicklich einem radioaktiven Zerfall unterliegen – der Emission von Kernteilchen wie α und β –, um eine größere Stabilität zu erreichen.
Wenn sie jedoch Kernpartikel emittieren, durchlaufen sie am Ende eine Kerntransmutation, das heißt, sie werden zu einem neuen chemischen Element. So müssen superschwere Elemente wie Nh im Labor hergestellt werden, was es zu einem macht synthetisches chemisches Element.
Nh wird wie andere superschwere Elemente beeinflusst von relativistische Effekte – auf einfache Weise die Abstände zwischen dem Beobachteten und dem Erwarteten aufgrund der Relativitätstheorie. So haben mathematische Studien im theoretischen Bereich, die die Folgen des relativistischen Effekts simulieren, darauf hingewiesen, dass Nihonium könnte schwach mit Quarz interagieren, aber haben gute Adsorption an Gold, wie sein leichteres Gegenstück, Thallium (Tl).
Vorläufige theoretische Studien deuteten auch darauf hin Volatilität von Nh. Was die Adsorption an Quarz betrifft, so bildet Thallium zum Beispiel leicht TlOH, und es wird vermutet, dass Nihonium dasselbe tut.
Trotzdem, wie Studien sind noch sehr vorläufig und neu, viel von dem, was produziert wurde, ist offen für Diskussionen, und es ist schwierig, die physikalisch-chemischen Eigenschaften von Nihonium genau zu bestimmen.
Erhalt des Nihoniums
Element 113 wurde bis heute auf zwei Arten gewonnen: durch kalte Fusionsreaktionen, mit der Fusion von Zink (Zn, Z = 30) mit Wismut (Bi, Z = 83), und auch durch die Alpha-Zerfall von Element 115.
Im ersten Beispiel ist die Zink wird auf 10% beschleunigt Lichtgeschwindigkeit, um die Abstoßungskräfte der beiden Kerne zu überwinden. Dann entsteht ein Isotop 279Nh, das am Ende ein Neutron emittiert und produziert 278Nh.

Mit einer Halbwertszeit von etwa 34 Millisekunden ist das Isotop 278Nh durchläuft sechs Alphazerfälle (Alphateilchenemissionen) zum Element Mendelevium (Md).
Im zweiten Fall entsteht Element 113 aus dem Alpha-Zerfall von Element 115 (jetzt bekannt als Muscovium), nachdem es synthetisiert wurde. Ein Weg ist die heiße Fusionsreaktion von Ionen 48Ca mit Isotopen 243ah, die Herstellung der 288Mc und dann, durch Alpha-Zerfall, die 284Nh, das weiterhin einem Alpha-Zerfall unterliegt.
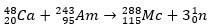
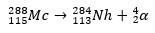
Auch sehen: Hassium – das schwerste synthetische chemische Element, dessen Eigenschaften analysiert werden
Geschichte des Nihoniums
Die Suche nach Element 113 begann im Jahr 2003. Japanische Forscher am Riken Institute beschleunigten Isotope von 70Zn mit 10 % der Lichtgeschwindigkeit, um mit dem zu kollidieren 209Bi, durch eine Fusionsreaktion. So gelang es ihnen, das zu produzieren, was wir heute kennen 278Nh.
Allerdings erst im Jahr 2012 Japanische Forscher konnten die komplette Alpha-Zerfallsreihe nachweisen von Element 113, Kontaktaufnahme mit IUPAC, um die Entdeckung zu beanspruchen.
Gleichzeitig mit japanischen Bemühungen, russische Wissenschaftler unter der Leitung von Yuri Oganessian, in Zusammenarbeit mit Amerikanische Wissenschaftler kamen auch dazu, das Element 113 durch Alpha-Zerfälle des Elements zu identifizieren 115. Solche Experimente führten auch dazu, dass russische und amerikanische Wissenschaftler um die Anerkennung von Element 113 stritten.

Die IUPAC fand jedoch die Beweise des Riken-Instituts solider und gab den Japanern das Recht, Element 113 zu benennen. Der gewählte Name war Nihônio, Symbol Nh, in Anlehnung an das Land Japan. Das Wort Japan wird von den Japanern mit zwei chinesischen Schriftzeichen geschrieben, die „Land der aufgehenden Sonne“ bedeuten und als Nihon oder Nippon gelesen werden.
Der Name Nihonium wurde auch deshalb gewählt, weil der japanische Chemiker Masataka Ogawa ihn 1908 veröffentlichte hatte Element 43 entdeckt und es japanisch genannt, Symbol Np (das heute zu Neptunium gehört, Z = 93). Später wurde jedoch bewiesen, dass Element 43 instabil war, in der Natur nicht vorkommt und erst 1937 synthetisiert wurde und den Namen erhielt Technetium (TC).
Damit verschwand Japanisch aus dem Periodensystem. Jahre später wurde jedoch bewiesen, dass Ogawa tatsächlich das Element 75 (heute bekannt als Rhenium). Allerdings war das Element Rhenium zu diesem Zeitpunkt bereits 1925 offiziell entdeckt und getauft worden.
Gelöste Übungen zu Nihonium
Frage 1
Nihonium, Symbol Nh und Ordnungszahl 113, ist ein chemisches Element, das aufgrund seiner kurzen Halbwertszeit nicht in der Natur vorkommt. Die beständigste von ihnen, die 286Nh, hat etwa 9,5 Sekunden. In dem Wissen, dass die Halbwertszeit die Zeit ist, die erforderlich ist, bis die Menge der Spezies um die Hälfte gesunken ist, Wie viele Sekunden dauert es, bis die Menge des obigen Isotops 1/16 der Menge beträgt? Initial?
A) 9.5
b) 19
c) 28.5
D) 38
E) 47.5
Auflösung:
Alternative d
Alle 9,5 Sekunden sinkt die Menge des Isotops um die Hälfte. Nach 9,5 Sekunden ist seine Menge also halb so groß wie die ursprüngliche Menge. Weitere 9,5 Sekunden, insgesamt 19 Sekunden, halbiert sich die Menge wieder und erreicht 1/4 des Anfangs.
Bei 28,5 Sekunden, nach einer weiteren Halbwertszeit, sinkt die Menge wieder um die Hälfte und erreicht 1/8 der Ausgangsmenge. Nach 38 Sekunden sinkt der Betrag schließlich wieder um die Hälfte und erreicht 1/16 des ursprünglichen Betrags, wie in der Erklärung gefordert. Somit beträgt die erforderliche Zeit 38 Sekunden.
Frage 2
2003 begann die Suche nach Element 113 am Riken Institute in Japan. Damals konnten Wissenschaftler die herstellen 278Nh durch die Fusion von Zink- und Wismutatomen.
Wie viele Neutronen enthält das angegebene Isotop?
a) 113
B) 278
C) 391
D) 170
E) 165
Auflösung:
Alternative E
Die Zahl der Neutronen kann berechnet werden als:
A = Z + n
wobei A die Zahl von ist Pasta atomar, Z ist die Ordnungszahl und n ist die Anzahl der Neutronen. Durch Einsetzen der Werte erhalten wir:
278 = 113 + n
n = 278 - 113
n = 165
Von Stefano Araújo Novais
Chemielehrer
