Der chemische Name von Vitamin C é L-Ascorbinsäure, oder einfach Askorbinsäure. Dieser Name vermittelt die chemische und biologische Rolle dieser Verbindung. Der chemische Aspekt ist, dass es sauer ist, da es in seiner Struktur eine phenolische Hydroxygruppe enthält. Die phenolische Gruppe, die an den dritten Kohlenstoff in der Kette gebunden ist, wird in wässriger Lösung ionisiert, wie unten gezeigt, wobei das Hydroxon-Ion (H3Ö+), die für das Säureverhalten charakteristisch ist:
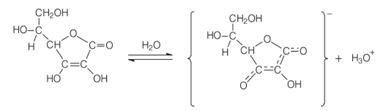
Das Wort "Ascorbinsäure" kommt von seiner biologischen Eigenschaft, die Krankheit Skorbut zu bekämpfen. Und das „L“ kommt von der Tatsache, dass Ascorbinsäure ein asymmetrisches Zentrum am Kohlenstoff 5 mit optischer Aktivität hat. Seine Anti-Skorbut-Wirkung leitet sich jedoch fast ausschließlich vom L-Isomer (Levogyro) ab, das in Wasser eine spezifische Drehung von 24° aufweist.
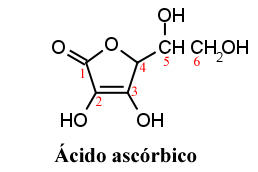
Ascorbinsäure wurde erstmals 1922 vom ungarischen Forscher Szent-Györgi als weißes kristallines Pulver isoliert.
Menschen und andere Tiere wie Affen, einige Vögel und einige Fische können Vitamin C nicht synthetisieren. Der Mangel an diesem Vitamin im Körper führt zu einer fehlerhaften Synthese von Kollagengewebe und der oben genannten Krankheit, die
Skorbut.Zwischen den Hauptlieferanten von Vitamin C, Wir haben frisches Obst wie Kirsche, Cashew, Guave, schwarze Johannisbeere, Mango, Orange, Acerola, Tomate und andere. Kartoffeln sind auch eine gute Quelle für Vitamin C, ebenso wie Paprika und Blattgemüse (Bertalha, Brokkoli, Grünkohl, Rüben, Maniokblätter und Süßkartoffeln).

Wir sagen "Früchte" frisch“, da Vitamin C bei längerer Lagerung ganz oder teilweise zerstört werden kann. Beispielsweise verliert die Kartoffel jeden Monat, wenn sie gelagert wird, 15% ihres Vitamin C. Außerdem kann Hitze es auch zerstören. Langgekochte und industriell verarbeitete Lebensmittel enthalten wenig Vitamin C. Im Fall von Kartoffeln verliert sie, wenn sie ohne Schale gekocht wird, sofort 30 bis 50 % ihrer Eigenschaften.
Eine der Haupteigenschaften von Ascorbinsäure ist ihre Fähigkeit, als Reduktionsmittel zu wirken. Da es in wässriger Lösung außergewöhnlich leicht oxidiert werden kann, ist es ein starkes Mittel Antioxidans, da es anstelle anderer Verbindungen oxidieren kann.
Wenn wir beispielsweise im Alltag bestimmte Früchte wie Birnen, Bananen und Äpfel schneiden, dunkeln sie mit der Zeit nach. Dies liegt daran, dass diese Früchte das Enzym Polyphenoloxidase enthalten, das in Gegenwart von molekularem Sauerstoff die enzymatische Oxidation natürlicher Phenolverbindungen unter Bildung von Chinonen bewirkt. Sie polymerisieren und erzeugen Melanine, die genau die dunklen, unlöslichen Pigmente sind, die wir in diesen Früchten bilden.
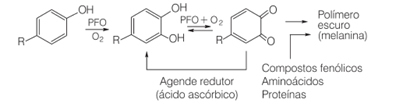
Eine der Möglichkeiten, die Wirkung des Polyphenoloxidase-Enzyms zu hemmen, ist die Zugabe von Ascorbinsäure. Dies geschieht zum Beispiel, wenn wir Orangensaft zu Obstsalat hinzufügen.
In Gegenwart von Sauerstoff und einem Katalysator oxidiert Ascorbinsäure und wird zum Dehydroascorbinsäure. Diese Säure hat einen pH-Wert unter 4 und eine Senkung des pH-Werts des Fruchtgewebes bewirkt eine Verlangsamung der Bräunungsreaktion. Bei pH unter 3 gibt es keine Enzymaktivität.
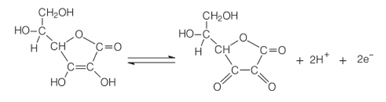
Diese Eigenschaft von Vitamin C wird häufig in Nahrungsmittelindustrie um das Auftreten von unangenehmem Geschmack, Toxizität und aus wirtschaftlichen Gründen zu verhindern, da schätzt, dass etwa 50 % der weltweiten Verluste an tropischen Früchten auf das Polyphenol-Enzym zurückzuführen sind Oxidase.
Aufgrund seiner antioxidativen Rolle wird Vitamin C auch in Kosmetika. Seine topische Anwendung durch diese Kosmetik ermöglicht es, Werte zu erreichen, die mit der oralen Einnahme von Vitamin C allein nicht möglich sind. Es schützt die Haut vor UV-Strahlen und freien Radikalen, die zu vorzeitiger Hautalterung führen.

Von Jennifer Fogaça
Abschluss in Chemie
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/composicao-aplicacoes-vitamina-c.htm
