Das Hesssche Gesetz wurde vom Schweizer Chemiker Germain H. Hess (1802-1850), der als einer der Begründer der Thermochemie gilt. Sein Gesetz sagte:

Das heißt, der ΔH hängt nur von den Enthalpiewerten der Reagenzien und Produkte ab, wie im Ausdruck:
| H = ΔHReagenzien + HProdukte |
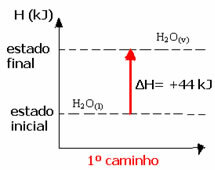
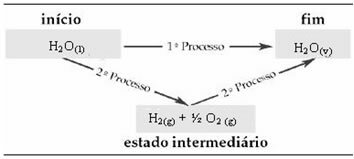
Betrachten Sie zum Beispiel die Reaktion, bei der 1 mol Wasser (H2O) wird im gasförmigen Zustand in Wasser umgewandelt. Diese Reaktion wird zweimal durchgeführt; jedoch wurden verschiedene Wege gewählt:
(1.) Es wurde in einem einzigen Schritt durchgeführt:
H2Ö(1) → H2Ö(v) ΔH= +44 kJ
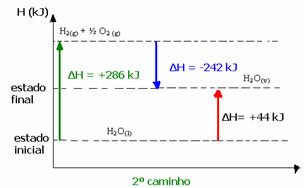
(2.) Es wurde in zwei Phasen durchgeführt:
1. Schritt: H2Ö(1) → H2(g) + ½ der2 (g) ΔH= +286 kJ
2. Stufe: H2(g) + ½ der2 (g) → H2Ö(v) ΔH= -242 kJ
H2Ö(1) → H2Ö(v) ΔH= +44 kJ
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
Beachten Sie, dass unabhängig davon, ob ein oder zwei Schritte durchgeführt wurden, die Enthalpieänderung (ΔH) immer 44 kJ beträgt. Dies liegt daran, dass ΔH die algebraische Summe der valoresH-Werte der Schritte ist, aus denen der Prozess besteht, dh der Zwischenprozesse:
| H = ΔH1 + H2 + H3 + ... |
Im zweiten Fall war das Gesamt-ΔH der Reaktion beispielsweise die Summe des ΔH des ersten Schrittes (ΔH= +286 kJ) mit dem des zweiten ( stepH= -242 kJ). Somit erhielten wir den gleichen Reaktionswert mit einem einzigen Schritt:
H = (+286 + (-242)) kJ
H = (+286 -242) kJ
H = +44 kJ
Daher interessieren uns nur die Anfangs- und Endwerte. In diesem Fall entspricht der Anfangszustand H2Ö(1) und das Ende von H2Ö(v).
Dieses Gesetz ist in der Thermochemie sehr wichtig geworden, da bei bestimmten chemischen Reaktionen ihr ΔH nicht experimentell bestimmt werden kann. Nach dem Hessschen Gesetz kann die Enthalpie dieser Reaktionsart jedoch aus den Enthalpien anderer Reaktionen (Zwischenreaktionen) berechnet werden.
Von Jennifer Fogaça
Abschluss in Chemie
Brasilianisches Schulteam
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
FOGAÇA, Jennifer Rocha Vargas. "Hess'sches Gesetz"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/quimica/lei-hess.htm. Zugriff am 28. Juni 2021.