Elektrolyse ist ein nicht spontane chemische Reaktion die eine Oxidations-Reduktions-Reaktion beinhaltet, die durch einen elektrischen Strom verursacht wird.
Damit die Elektrolyse stattfindet, muss der elektrische Strom kontinuierlich sein und eine ausreichende Spannung aufweisen.
Damit die beteiligten Ionen Bewegungsfreiheit haben, kann die Elektrolyse durch Fusion (Magnetelektrolyse) oder durch Auflösung (Elektrolyse in Lösung) erfolgen.
Elektrolyseanwendungen
Beim Elektrolyseprozess werden viele Materialien und chemische Verbindungen hergestellt, zum Beispiel:
- Aluminium und Kupfer
- Wasserstoff und Chlor im Zylinder
- Modeschmuck (Galvanisierungsprozess)
- Dampfkochtopf
- Magnesiumrad (Auto-Radkappen).
Gesetze der Elektrolyse
Die Gesetze der Elektrolyse wurden von dem englischen Physiker und Chemiker Michael de Faraday (1791-1867) entwickelt. Beide Gesetze regeln die quantitativen Aspekte der Elektrolyse.
DAS Erstes Gesetz der Elektrolyse hat folgende Aussage:
“Die Masse eines Elements, die während des Elektrolyseprozesses abgeschieden wird, ist direkt proportional zur Strommenge, die durch die Elektrolysezelle fließt”.
Q = ich. t
Wo,
Q: elektrische Ladung (C)
ich: Stromstärke (A)
t: Zeitintervall des Durchgangs von elektrischem Strom (s)
DAS Zweiter Hauptsatz der Elektrolyse hat folgende Aussage:
“Die Massen verschiedener Elemente sind, wenn sie während der Elektrolyse mit der gleichen Elektrizitätsmenge abgeschieden werden, direkt proportional zu ihren chemischen Äquivalenten”.
M = K. UND
Wo,
M: Stoffmasse
K: Proportionalitätskonstante
UND: Grammäquivalent der Substanz
Erfahren Sie mehr im Artikel: Faradays Konstante.
Einstufung
Der Elektrolyseprozess kann durch Schmelzen oder Auflösen erfolgen:
Eruptivelektrolyse
Die magmatische Elektrolyse ist diejenige, die aus einem geschmolzenen Elektrolyten verarbeitet wird, d. h. durch den Prozess von Verschmelzung.
Nehmen wir als Beispiel NaCl (Natriumchlorid). Wenn wir die Substanz auf 808 °C erhitzen, verschmilzt sie und die vorhandenen Ionen (Na+ und Cl-) beginnen im flüssigen Zustand eine größere Bewegungsfreiheit zu haben.
wenn der elektrischer Strom gelangt in die Elektrolysezelle, die Na-Kationen+ sie werden vom negativen Pol, der Kathode genannt, angezogen. Schon die Anionen von Cl-, werden vom Pluspol oder der Anode angezogen.
Im Fall von Na+ eine Reduktionsreaktion stattfindet, während in Cl-, es gibt eine Reaktion von Oxidation.
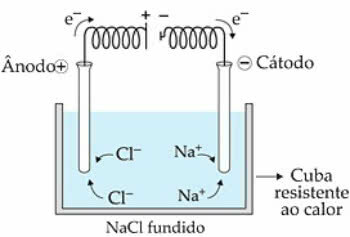
Schema der magmatischen NaCl-Elektrolyse
Wässrige Elektrolyse
Bei der wässrigen Elektrolyse wird als ionisierendes Lösungsmittel Wasser verwendet. In wässriger Lösung kann die Elektrolyse mit invertierten Elektroden oder aktiven (oder reaktiven) Elektroden durchgeführt werden.
Inerte Elektroden: das Wasser in der Lösung ionisiert nach der Gleichung:
H2O ↔ H+ + OH-
Mit dem Dissoziation von NaCl haben wir:
NaCl → Na+ + Cl-
Somit sind die H-Kationen+ und weiter+ können am Minuspol entladen werden, während OH-Anionen- und Cl- am Pluspol entladen werden kann.
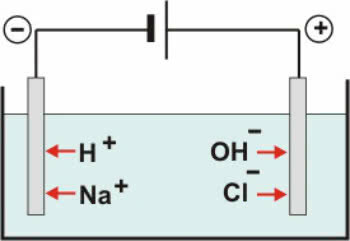
Schema der wässrigen NaCl-Elektrolyse
Bei Kationen findet eine Reduktionsreaktion (kathodische Reduktion) statt, bei Anionen eine Oxidationsreaktion (anodische Oxidation).
Wir haben also die Elektrolysereaktion:
2 NaCl + 2 H2O → 2 Zoll+ + 2 OH- + H2 + Cl2
Daraus können wir schließen, dass NaOH-Moleküle in Lösung bleiben, während H2 wird am Minuspol freigegeben und das Cl2, am Pluspol.
Dieser Vorgang führt zu der äquivalenten Gleichung:
2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2
Aktive Elektroden: In diesem Fall nehmen die aktiven Elektroden an der Elektrolyse teil, leiden jedoch unter Korrosion.
Als Beispiel haben wir die Elektrolyse in wässriger Lösung von Kupfersulfat (CuSO4):
CUSO4 → Cu2 + Betriebssystem 2-4
H2O → H+ + OH-
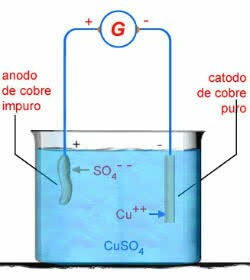 Schema der wässrigen CuSO-Elektrolyse4
Schema der wässrigen CuSO-Elektrolyse4
In diesem Fall korrodiert die Kupferanode:
Arsch0 → Cu2+ + 2e-
Dies liegt daran, dass der elektrische Strom gemäß den Standardpotentialen der Elektroden die Elektronen leichter aus dem Cu. entfernen kann0 als das Betriebssystem 2-4 oder von oh-.
Am Minuspol findet daher folgende Elektrolysereaktion statt:
2e- + Cu2+ → Cu
Am Pluspol haben wir die Elektrolysereaktion:
Cu → Cu2+ +2e-
Schließlich, wenn wir die beiden Elektrolysegleichungen addieren, haben wir als Ergebnis Null.
Sie möchten mehr zum Thema erfahren? Lesen Sie die Artikel:
- Ion, Kation und Anion
- Chemische Reaktionen
- Oxidationsreaktionen
Batterie und Elektrolyse
Die Elektrolyse basiert auf einem umgekehrten Phänomen wie das der Batterie. Bei der Elektrolyse ist der Vorgang nicht spontan wie bei Batterien. Mit anderen Worten wandelt die Elektrolyse elektrische Energie in chemische Energie um, während die Zelle aus chemischer Energie elektrische Energie erzeugt.
mehr wissen über Elektrochemie.
Übungen
1. (Ulbra-RS) Metallisches Kalium kann durch die magmatische Elektrolyse von Kaliumchlorid hergestellt werden. Kreuzen Sie in dieser Aussage die richtige Alternative an.
a) Die Elektrolyse ist ein Prozess, der durch elektrischen Strom motivierte Oxidations-Reduktions- und Reduktionsreaktionen umfasst.
b) Die magmatische Elektrolyse von Kaliumchlorid findet bei Raumtemperatur statt.
c) Kalium kommt in der Natur in reduzierter Form (K0).
d) Die Elektrolysereaktion erfolgt mit Hilfe von ultravioletter Strahlung.
e) Bei der Elektrolyse von Kaliumchlorid, um metallisches Kalium zu erhalten, findet die Übertragung von Elektronen von Kalium auf Chlor statt.
Als Alternative
2. (UFRGS-RS) In der Kathode einer Elektrolysezelle befindet sich immer:
a) Metallabscheidung.
b) Eine Reduktionshalbreaktion.
c) Erzeugung von elektrischem Strom.
d) Freisetzung von Wasserstoffgas.
e) Chemische Korrosion.
Alternative b
3. (Unifor-CE) Die folgenden Vorschläge beziehen sich auf die Elektrolyse:
ICH. Elektrolysereaktionen treten unter Verbrauch von elektrischer Energie auf.
II. Wässrige Glucoselösungen können nicht elektrolysiert werden, da sie keinen elektrischen Strom leiten.
III. Bei der Elektrolyse von Salzlösungen werden metallische Kationen oxidiert.
Das können wir nur sagen:
a) Ich habe recht.
b) II ist richtig.
c) III ist richtig.
d) I und II sind richtig.
e) II und III sind richtig.
Alternative
4. (FEI-SP) Zwei Chemiestudenten führten BaCl-Elektrolyse durch2; die erste wässrig und die zweite feurig. Bezüglich des Ergebnisses können wir sagen, dass beide erhalten wurden:
a) H2 es ist das2 an den Anoden.
b) H2 und Ba an den Anoden.
c) Cl2 und Ba auf den Elektroden.
d) H2 an den Kathoden.
e) Cl2 an den Anoden.
Alternativ und
5. (Vunesp)"Pool ohne Chemie“ ist eine Werbung für die Wasseraufbereitung. Es ist jedoch bekannt, dass die Behandlung darin besteht, dem Wasser Natriumchlorid zuzusetzen und dieses zu leiten Wasser durch einen Behälter mit Kupfer- und Platinelektroden, die an eine Leitung angeschlossen sind Wagen.
a) Besprechen Sie anhand dieser Informationen, ob die Werbebotschaft richtig ist
b) Schreiben Sie unter Berücksichtigung der inerten Elektroden die Reaktionsgleichungen auf, die die vorherige Antwort begründen.
a) Die Werbebotschaft ist nicht korrekt, da sich chemische Produkte bilden.
b) 2 NaCl + 2H2O → 2 NaOH + H2 + Cl2 (Reaktion, die Chlor bildet, nützlich bei der Behandlung von Poolwasser)
2 NaOH + Cl2 → NaCl + NaClO + H2O (Reaktion, die NaClO bildet, ein starkes Bakterizid)


