Ö Atommodell von Thomson wurde im Jahr 1898 von dem englischen Physiker Joseph John Thomson oder einfach J.J. Thomson vorgeschlagen. Nach mehreren experimenteller Beweis für die Existenz des Elektrons, kippte er die Theorie der Unteilbarkeit des Atoms von John Dalton.
Thomson, basierend auf seinem Modell, bestätigte und bewies die Existenz von Elektronen (Teilchen mit negativer elektrischer Ladung) im Atom, dh das Atom hat subatomare Teilchen.
Mindmap: Atommodell von Thomson
* Um die Mindmap als PDF herunterzuladen, Klicke hier!
Thomson schlug sein Atommodell vor basierend auf Entdeckungen im Zusammenhang mit Radioaktivität und Experimenten mit der von den Wissenschaftlern Geissler und Crookes gebauten Kathodenstrahlröhre. Sehen Sie eine Darstellung dieser Röhre:
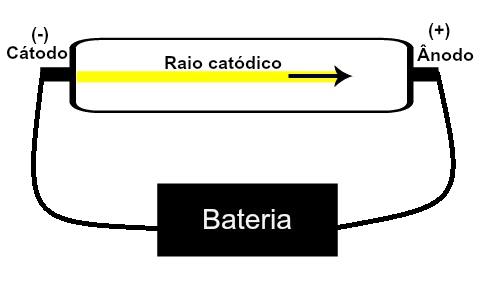
Wenn ein verdünntes Niederdruckgas einer hohen elektrischen Spannung (z. B. 15000 V) ausgesetzt wird, entsteht ein Lichtstrahl (bestehend aus elektrischen Ladungen) von der Kathode (Minuspol) zur Anode (Pol positiv).
Mit diesem Experiment kam Thomson zu dem Schluss, dass, wenn die Atome des gasförmigen Materials im Inneren der Röhre wurden einer Hochspannung ausgesetzt, ihre Elektronen wurden herausgerissen und auf die Platte gelenkt positiv.
Überlegungen des Thomson-Atommodells
Mit den Experimenten mit der Kathodenstrahlröhre schlug Thomson seine Interpretation des Atoms und seiner Konstitution vor. Also laut ihm:
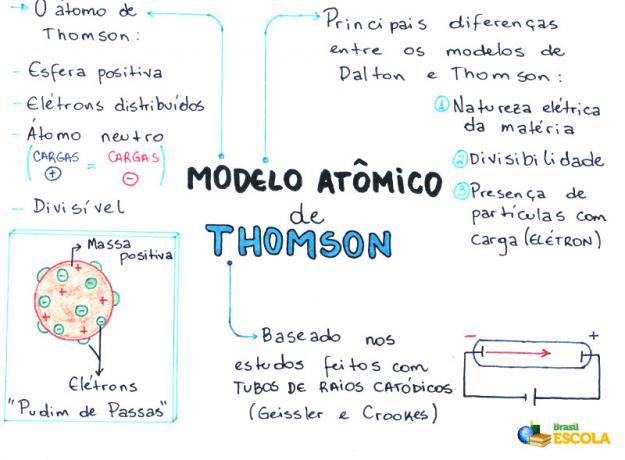
- Das Atom ist eine Kugel, aber nicht massiv, wie von der John Dalton Atommodellton;
- Das Atom ist neutral, da alle Materie neutral ist;
- Da das Atom Elektronen hat, die negativ geladen sind, muss es daher positive Teilchen haben, damit die endgültige Ladung null ist;
- Elektronen sind nicht im Atom fixiert oder gefangen, sie können unter bestimmten Bedingungen auf ein anderes Atom übertragen werden;
- Das Atom kann als kontinuierliche Flüssigkeit mit positiven Ladungen betrachtet werden, in der Elektronen, die eine negative Ladung haben, verteilt würden;
- verbunden mit deinem Modell zu einem Rosinenpudding (die die Elektronen darstellen);
- Da die gestreuten Elektronen die gleiche Ladung haben, findet eine gegenseitige Abstoßung zwischen ihnen statt, wodurch sie gleichmäßig in der Kugel verteilt werden.
Neuheiten, die dem Atom durch das Thomson-Modell vorgeschlagen werden
Das Atommodell von Thomson war das zweite, das für das Atom vorgeschlagen wurde. Das erste Modell wurde von John Dalton formuliert.
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
Thomsons Modell befasste sich mit neuen Erkenntnissen über das Atom, die bis dahin mangels wissenschaftlicher Grundlage nicht vorgeschlagen wurden, wie zum Beispiel:
- Elektrische Natur der Materie;
- Atomspaltbarkeit;
- Anwesenheit von kleinen geladenen Teilchen im Atom.
Auf das Thomson-Atom hingewiesene Probleme
Mehrere Physiker zum Zeitpunkt des Vorschlags der Atommodell von Thomson, basierend auf den Theorien der klassischen Physik, wies auf einige Inkonsistenzen in diesem Modell hin:
- Thomson schlug vor, dass das Atom in Bezug auf die gleichmäßige Verteilung der Elektronen eine Stabilität besitzt, die durch den Einfluss von Energie verändert werden kann. Die klassische Physik, basierend auf Elektromagnetismus, erlaubt nicht die Existenz eines stabilen Systems, das nur auf der Abstoßung zwischen Teilchen derselben Ladung beruht;
- Für Thomson sind Elektronen gleichmäßig im Atom verteilt, aber sie haben die Fähigkeit, verschieben sich beschleunigt und müssen daher elektromagnetische Strahlung mit bestimmten Frequenzen emittieren Spezifisch. Dies wurde jedoch nicht beobachtet.
- Thomsons Modell war oft ineffektiv bei der Erklärung atomarer Eigenschaften wie ihrer Zusammensetzung und Organisation.
* Mindmap von Victor Ricardo Ferreira
Chemielehrer
Von mir. Diogo Lopes Dias
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
TAGE, Diogo Lopes. "Thomsons Atommodell"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/quimica/o-atomo-thomson.htm. Zugriff am 27. Juni 2021.
Chemie

Niels Bohr, Bohrs Atom, Atomphysik, stabiles Atom, Atommodell, Planetensystem, Schichten der Elektrosphäre, Energieniveaus, Elektronenhüllen, Elektronenenergie, Rutherford-Atommodell, Atom im angeregten Zustand.
Chemie

Atome und der Aufbau des Universums, Atomtheorie, dass alles gemacht ist, Materie besteht aus Atomen, Theorie der vier Elemente, alte Alchemisten, Atomtheorie, fundamentale Teilchen.