Im Jahr 1911 entdeckte der neuseeländische Wissenschaftler Ernest Rutherford der wissenschaftlichen Gemeinschaft vorgestellt sein atomares Modell. Rutherfords Modell, auch Sonnensystemmodell genannt, war das dritte in der Geschichte der Atomistik (die ersten beiden waren das Modell von Dalton und Thomsons Modell) und galt als das Modell, das die gesamte Wissensentwicklung über den Bestandteil der Materie, das Atom, anregte.
Der Bau des Rutherford-Modell begann mit dem Studium der Eigenschaften von Röntgen und radioaktive Emissionen, die in der Verwendung von Strahlung auf einem inerten Artefakt gipfeln, dh einem, das nicht leicht reagiert.
Experiment durchgeführt von Rutherford
Das von Rutherford durchgeführte Experiment hatte die folgende Apparatur und Organisation:
Komponente a - eine Probe Polonium (Emitter von Alphastrahlung) auf einem Bleiblock platziert. In diesem Block befand sich ein kleines Loch, durch das die Strahlung gelangte;
Komponente b: sehr dünne Goldklinge vor dem Bleikasten positioniert;
Komponente c: Metallplatte mit fluoreszierendem Material (Zinksulfid) bedeckt hinter, neben und etwas vor der Goldplatte.
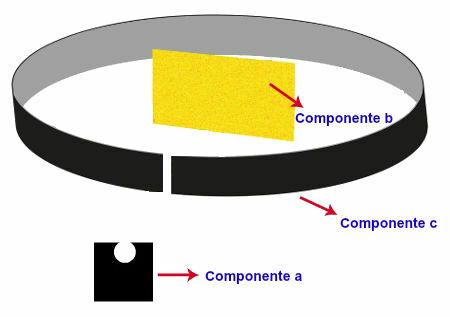
Darstellung des Experiments von Rutherford
Ergebnisse des Rutherford-Experiments
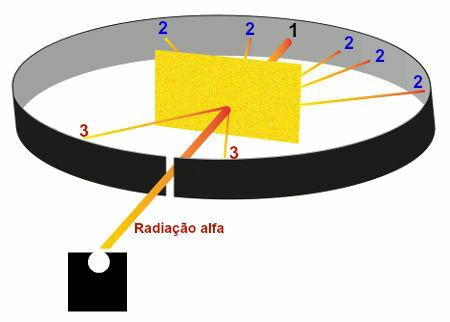
Darstellung der im Rutherford-Experiment beobachteten Ergebnisse
Region 1: Gebiet, das einen großen Teil der von Polonium emittierten Alphastrahlung erhielt, was zeigte, dass diese Strahlungen die Goldplatte ohne erhebliche Abweichungen durchquerten;
Region 2: mehrere Bereiche, die sich hinter der Goldplatte befanden, die eine geringe Menge Alphastrahlung erhielten, aber nicht in Richtung des Strahlungsaustrittsloch in der Bleibox, das zeigte, dass diese Strahlungen nach dem Überqueren der Gold;
Region 3: Bereiche vor der Goldplatte, die eine extrem geringe Menge an Alphastrahlung erhielten, was zeigte, dass ein Teil der Alphastrahlung mit der Platte kollidierte und zurückgeworfen wurde.
Interpretationen der Ergebnisse des Rutherford-Experiments
Interpretation über Region 1: Da ein Großteil der Alphastrahlung ungehindert durch die Goldplatte gelangt ist, bedeutet dies, dass die Atome hatte große Leerräume (Elektrosphäre), d. h. Bereiche, die nichts hatten, was die Strahlung beeinflussen konnte Alpha;
Interpretation zu Region 2: Die kleine Menge an Alphastrahlung, die einer Abweichung unterzogen wurde, passierte nahe einem positiven Bereich (Kern) des Atoms, wahrscheinlich von geringer Größe, was die Abweichung begünstigte.
Interpretation über Region 3: Da eine extrem kleine Menge an Alphastrahlung zurückgeworfen wurde, bedeutet dies, dass sie mit einem extrem kleinen Bereich des Atoms kollidiert ist, der eine positive Charakteristik aufwies.
Eigenschaften des Rutherford-Atommodells
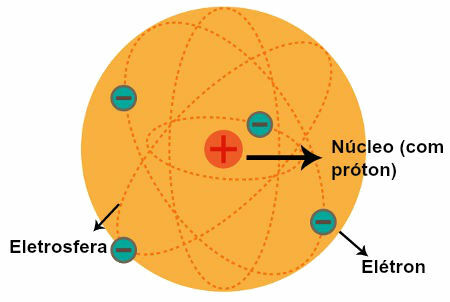
Darstellung des Rutherford Atommodells
Nach Beobachtungen von Rutherford formulierte er sein Atommodell, das folgende Eigenschaften aufwies:
a) Kern (der mit der Sonne im Sonnensystem verglichen wurde)
Eine zentrale Region des Atoms mit:
positive Teilchen (die Protonen);
niedrige Lautstärke;
größere Masse;
größer Dichte des Atoms.
b) Elektrosphären (die mit Bahnen verglichen wurden, die von Planeten im Sonnensystem beschrieben werden)
Regionen des Atoms mit:
riesige leere Räume zwischen ihnen;
Teilchen negativer Natur (die Elektronen).
Von mir. Diogo Lopes Dias
Quelle: Brasilien Schule - https://brasilescola.uol.com.br/quimica/o-atomo-rutherford.htm
