Seit der Antike interessiert sich der Mensch für die Beantwortung der Frage nach der Konstitution der Materie.
Mehrere Persönlichkeiten aus der wissenschaftlichen Gemeinschaft bezogen sich zu diesem Thema, doch erst Ende des 19. Jahrhunderts begannen die Mysterien um die atomare Zusammensetzung zu lüften.
Der antike Philosoph Leukipp zum Beispiel glaubte, das Atom bestehe aus winzigen Teilchen.
Nach dieser Definition wurde von Demokrit und Dalton vorgeschlagen, dass Atomteilchen massiv und unteilbar sind.
Diese Tatsache wurde später von Thomson bestritten, einem englischen Physiker, der die Existenz des Elektrons entdeckte und dann die zuvor von Leucipo vorgeschlagene Idee bestätigen konnte.
Nach dieser Entdeckung präsentierte Thomson ein Modell, bei dem das Atom aus einer Kugel positiver Ladungen gebildet wurde und sich im Kern Elektronen befanden.
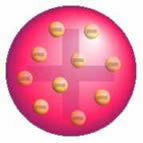
Thomsons Atommodell - In einer positiv geladenen, gleichmäßig verteilten Massenkugel,
sie wären mit negativ geladenen Elektronen verkrustet, wie in Pudding.
Auch nach Thomsons Theorie hatte das Atommodell noch einen theoretisch-experimentellen Mangel, der seine Richtigkeit beweisen konnte.
Das Thema wurde noch einmal heiß diskutiert, als das Team des Physikers Rutherford feststellte, dass es eine sehr große Abweichung gibt (und nach der Rosinenpudding-Theorie unerklärlich), wenn einige radioaktive Alphateilchen eine dünne Schicht aus Plättchen durchdrangen metallisch.
Nach Analyse und Studium der Tatsache kam Rutherford zu dem Schluss, dass der Radius des Atoms 10.000 mal größer ist als der Radius des Kerns.
Durch all das Studium des Atoms gelangten Rutherford und sein Team 1911 zu einem Atommodell, das sie das Planetenmodell des Atoms nannten.
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)

1913 entschlüsselte Niels Bohr das Atommodell und wandte das von Planck entdeckte Wirkungsquantum für seine Studien an. Das Aktionsquantum war in der Tat der große Joker, der das Atommodell vervollständigen und verdeutlichen sollte.
Bohr passte das von Rutherford vorgestellte Modell effizient und einfach an und kam zu folgendem Ergebnis:
Das Elektron erhält Energie, die durch eine definierte Umlaufbahn dargestellt wird. Die erlaubten Bahnen bilden die Energieniveaus.

Von Talita A. Engel
Abschluss in Physik
Brasilianisches Schulteam
Physik Modern - Physik - Brasilien Schule
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
ENGEL, Talita Alves dos. „Vom Atom Rutherfords zum Atom Bohrs“; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/fisica/do-atomo-rutherford-ao-atomo-bohr.htm. Zugriff am 27. Juni 2021.