DAS Aktivierungsenergie es ist die minimale Energiemenge, die erforderlich ist, damit die Kollision zwischen den in einer günstigen Ausrichtung vorgenommenen Reaktantenteilchen stattfindet und zu einer Reaktion führt.
Reaktionen treten nur auf, wenn die Reaktanten eine Aktivierungsenergie haben (oder die erforderliche Mindestenergie, die von Reaktion zu Reaktion variiert; entweder in Menge oder Form) oder wenn es ihnen geliefert wird.
Wenn beispielsweise metallisches Natrium mit Wasser in Kontakt kommt, reagiert es heftig. Dies bedeutet, dass der Energieinhalt dieser Reaktionspartner bereits ausreicht, um die Reaktion ablaufen zu lassen.
Beim Anschalten eines Ofens erfolgt die Verbrennungsreaktion nur, wenn wir ein brennendes Streichholz oder eine andere Feuerquelle in die Nähe des vom Ofen freigesetzten Gases platzieren. Dies bedeutet, dass in diesem Fall dem System Energie zugeführt werden musste, damit es die Aktivierungsenergie erreichte und die Reaktion ablief.
Bei dem verwendeten Leuchtstoff selbst wird für dessen Verbrennung die Aktivierungsenergie durch Reibung bereitgestellt. Das gleiche passiert mit Feuerzeugen, die ebenfalls einen Funken benötigen, der die notwendige Aktivierungsenergie für die Verbrennung des darin enthaltenen Gases liefert.
Aktivierungsenergie kann auch durch Licht bereitgestellt werden, wie dies bei der Zersetzung von Wasserstoffperoxid der Fall ist. Deshalb wird es in dunklen oder undurchsichtigen Flaschen aufbewahrt.
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)

Daraus können wir schließen, dass die Aktivierungsenergie (Ebis um) ist die Differenz zwischen der zum Start der Reaktion benötigten Energie (E) und der in den Reaktanten enthaltenen Energie (Epr):

Aktivierungsenergie ist ein Hindernis für die Reaktion und wird benötigt, um die Bindungen der Reaktanten aufzubrechen. Damit findet die Reaktion statt und es werden neue Verbindungen zu den Produkten hergestellt.
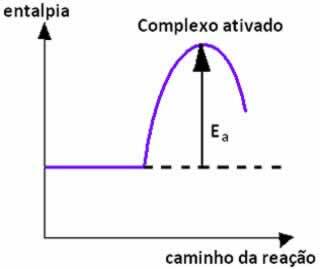
Wenn die Kollision zwischen Teilchen von Reaktanten mit günstiger Orientierung mit gleicher Energie oder höher als die Aktivierungsenergie ist, wird vor der Bildung der Produkte ein intermediärer und instabiler Zustand gebildet, denominiert Komplex aktiviert, bei der die Eduktbindungen geschwächt werden und die Produktbindungen gebildet werden. So, Aktivierungsenergie ist die Energie, die benötigt wird, um den aktivierten Komplex zu bilden.
Unten haben wir eine Grafik, die die Aktivierungsenergie als Barriere für die stattfindende Reaktion zeigt:
Von Jennifer Fogaça
Abschluss in Chemie
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
FOGAÇA, Jennifer Rocha Vargas. "Aktivierungsenergie"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/quimica/energia-ativacao.htm. Zugriff am 27. Juni 2021.