Der Wissenschaftler Friedrich Kohlrausch (1840-1910) schlug als erster vor, dass reines Wasser Elektrizität leitet, wenn auch in kleinem Maßstab. Dies liegt daran, dass sich Wasser amphoter verhält; das heißt, bei bestimmten Gelegenheiten wirkt es wie eine Säure und spendet Protonen (H+); und in anderen verhält es sich wie eine Base, die Protonen empfängt.
Dies bedeutet, dass Wasser seine eigene Ionisierung gemäß der folgenden chemischen Gleichung durchführt:
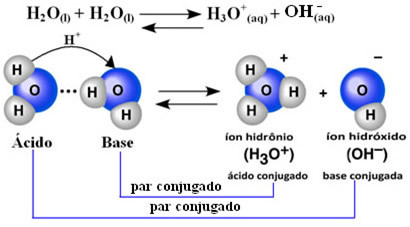
Dieser Vorgang heißt Wasser-Autoionisation und es tritt in einem sehr kleinen Maßstab auf, dh Wasser ist ein sehr schwacher Elektrolyt mit niedrigen Ionisationsgrad- und Ionisationskonstanten im Gleichgewicht (Kç). Genau deshalb hat Wasser eine so geringe Leitfähigkeit.
Um eine Vorstellung zu bekommen, kann man bei einer Umgebungstemperatur von 25°C feststellen, dass die Konzentrationen an Hydroxid- und Hydroniumionen, die bei der Selbstionisierung von reinem Wasser entstehen, gleich 1 sind. 10-7 mol. L-1. Das bedeutet, dass von einer Milliarde Wassermolekülen nur zwei ionisieren.
Die Ionengleichgewichtskonstante von Wasser heißt çWasserdissoziationskonstante,Autoprotolysekonstanteoder ionisches Produkt von Wasser.Diese Konstante wird dargestellt durch Kw, denn das w bezieht sich auf das Wort Wasser, was auf Englisch Wasser bedeutet.
Hör jetzt nicht auf... Nach der Werbung kommt noch mehr ;)
Seine Berechnung erfolgt auf die gleiche Weise wie bei den anderen Gleichgewichtskonstanten, wobei zu beachten ist, dass, wie im Text "Konstanten von Balance Kc und Kp“, in diesem Fall erscheinen nur die Produkte im Ausdruck, da Wasser im flüssigen Zustand die gleiche Aktivität hat bis 1. Reine flüssige oder feste Stoffe werden nicht in den Dissoziationskonstantenausdruck gestellt, da sie sich nicht ändern. Es werden nur wässrige und gasförmige Lösungen eingebracht. Also haben wir:
Kw = [H3Ö+]. [Oh-]
Kw = (1. 10-7). (1. 10-7)
Kw = 10-14
Wie bei den anderen Gleichgewichtskonstanten gilt OKw es ändert sich nur mit der Temperaturänderung. Mit steigender Temperatur des Wassers nimmt auch seine Ionisierung zu, was bedeutet, dass die Selbstionisierung von Wasser ein endothermer Prozess ist, das heißt, es nimmt Wärme auf.
Dies ist an den Werten des ionischen Produkts von Wasser (Kw) in der folgenden Tabelle bei verschiedenen Temperaturen angegeben:
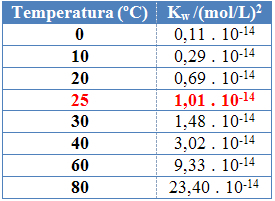
Das ionische Produkt von Wasser hat bei jeder Temperatur immer einen festen Wert, sei es in reinem Wasser oder in Lösung. Auch wenn die Lösung Konzentrationen von H-Ionen enthält3Ö+ und oh- unterschiedlich ist, bleibt das Produkt zwischen ihnen konstant.
Von Jennifer Fogaça
Abschluss in Chemie
Möchten Sie in einer schulischen oder wissenschaftlichen Arbeit auf diesen Text verweisen? Aussehen:
FOGAÇA, Jennifer Rocha Vargas. "Ionisches Wasserprodukt (Kw)"; Brasilien Schule. Verfügbar in: https://brasilescola.uol.com.br/quimica/produto-ionico-Agua-kw.htm. Zugriff am 28. Juni 2021.



