det kemiske element fosfor (P) tilhører den tredje periode i det periodiske system og til kvælstof (VA) -familien. Af denne grund udgør dets atomer normalt tre kemiske bindinger at nå oktetteori (stabilitet). Der er dog nogle situationer, hvor et fosforatom danner mere end tre bindinger, en kendsgerning, der kun er mulig gennem hybridiseringsfænomen.
At forstå fosfor hybridisering, vi må først forstå, hvorfor dette elements atom danner tre bindinger. For at gøre dette skal vi bare overvåge din elektroniske distribution:

Elektronisk fosfor distribution
Vi kan konstatere, at i valenslaget har phosphoratomet det komplette 3s underniveau (med to elektroner) og det ufuldstændige 3p subniveau (hver af de tre p subniveau orbitaler har en elektron). Nedenfor har vi fordelingen af elektronerne i orbitalerne på subniveauerne af Fosforvalenslag:
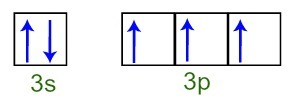
Repræsentation af valensskalelektronerne i fosforatomet
Da hver af de 3p subniveau orbitaler er ufuldstændige, er phosphoratomet i stand til at danne tre kemiske bindinger og derved opnå stabilitet.
Nu når vi ser på stoffet PCl5for eksempel er vi sikre på, at phosphoren i dette molekyle gennemgik hybridisering, da det lavede fem forbindelser. Da klor, der hører til VIIA-familien, har brug for en binding for at være stabil, og molekylet har fem atomer af dette element, skal hver af dem skabe en binding, hvilket gør, at fosforatomet igen også skal gøre fem Forbindelser. Denne forekomst er kun mulig gennem hybridisering (forening af ufuldstændige atomorbitaler) af fosfor.
Stop ikke nu... Der er mere efter reklamen;)
Når man modtager energi fra det ydre miljø, bliver fosforatomens elektroner ophidsede. Kort efter bevæger den ene af de to elektroner, der hører til 3s-underniveauet, til en tom orbital, der er til stede i d-underniveauet, som indtil da ikke har nogen elektroner. Se diagrammet nedenfor:
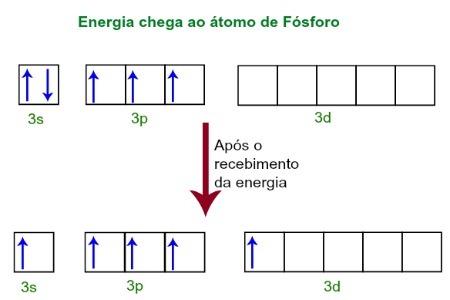
Efter modtagelse af energi exciteres fosforelektronerne, og man indtager en orbital af underunderniveauet.
I dette øjeblik har vi i fosforets valenslag en orbital, tre p orbitaler og en ufuldstændig orbital.I sidste ende hybridiserer disse fem orbitaler, dvs. fusionerer, hvilket resulterer i fem ufuldstændige atomorbitaler, som nu er i stand til at danne fem kemiske bindinger.

Hybridisering af ufuldstændige atomorbitaler af fosfor
Som en s orbital, blev tre p orbitaler og en d orbital forbundet, Phosphor hybridisering er af typen sp3d.
Af mig. Diogo Lopes Dias
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
DAGE, Diogo Lopes. "Hybridisering af fosfor"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm. Adgang til 28. juni 2021.