Overfladespænding er et fænomen, der opstår på overfladen af væsker, såsom vand, der danner en tynd film.
Når vand i flydende tilstand optager en beholder, kan vi opfatte adskillelsen mellem væsken og miljøet. Dette skyldes, at interaktionen mellem vandmolekyler på overfladen er forskellig fra interaktionerne inde i væsken.
På overfladen interagerer et vandmolekyle med molekylerne på siderne og under det. Inde er et molekyle omgivet af andre molekyler, og der er interaktion i alle retninger gennem hydrogenbindinger.
Det er på grund af denne egenskab, at vi observerer fænomenet dannelse af en dråbe. På grund af dette er det også muligt for insekter at gå på vand.
Hvad er overfladespænding?
Det er dannelsen af en tynd film under en væske på grund af uligheden af attraktioner mellem molekylerne, der udgør den. Dette fænomen forekommer mere markant i væsker, der har intermolekylære kræfter intens, ligesom vand.
Interaktioner mellem arter i en væske kaldes sammenhængende kræfter. Mens molekyler inde i en væske tiltrækkes af nabomolekyler i alle retninger, interagerer molekyler på overfladen med molekylerne nedenfor og ved siden af dem.
Se hvordan overfladespænding opstår i vand.
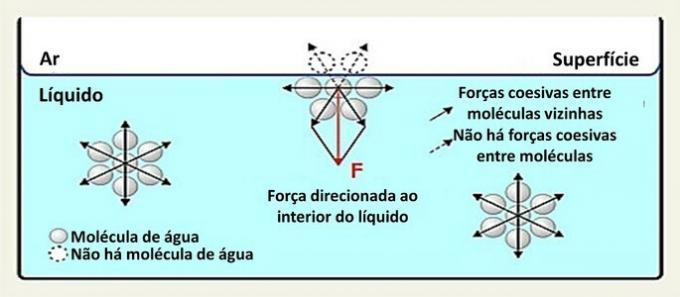
Vandet (H.2O) er et polært molekyle dannet af 2 hydrogenatomer (positive poler) og et oxygenatom (negativ pol) forbundet med kovalente bindinger. Den positive pol i et molekyle tiltrækkes af den negative pol i det tilstødende molekyle, der danner hydrogenbindinger.
Denne type interaktion i væsken fordeles i alle retninger. På overfladen er kræfterne rettet nedad og sidelæns, for over dem er der ingen vandmolekyler. Dette gør overflademolekylerne mere sammenhængende og skaber en elastisk film.
Overfladespændingsenheden er givet af kvotienten mellem kraftenhed og længdeenhed, hvor den mest anvendte er dyne / centimeter (dyne / cm) og newton / meter (N / m).
Vand har en høj overfladespænding, hvis værdi er 72,75 dyne / cm. Imidlertid har kviksølv, et flydende metal, en overfladespænding, der er ca. 7 gange større end vand, 475 dyne / cm.
Vil du vide mere? Så tjek følgende tekster:
- Vandegenskaber
- Polære og apolære molekyler
- Kemiske bindinger
Fænomener forårsaget af overfladespænding
Overfladespænding er ansvarlig for nogle fænomener, vi observerer i hverdagen. De vigtigste er:
Dyr, der går på vand

Insekter, edderkopper og andre dyr kan gå eller hvile på Vand fordi der på hårets ekstremiteter er hår overtrukket med et fedtet stof, og derfor kan de ikke trænge ind mellem de vandmolekyler, der er forbundet på overfladen.
Dannelse af vanddråber

Vanddråberne er sfæriske på grund af sammentrækningen i molekyler overfladen forårsaget af overfladespænding. Kuglen opstår, fordi dette er den geometriske form, hvor der er den mindste sammenhæng mellem overfladeareal og volumen. Derfor holder den sfæriske form det færreste antal vandmolekyler i kontakt med luften.
Øvelser på overfladespænding af vand
1. Et overfladeaktivt middel er et stof, der virker på et andet for at ændre:
a) Osmolaritet.
b) Overfladespænding.
c) Elektroforese.
d) Viskositet.
e) Osmotisk tryk.
Korrekt alternativ: b) Overfladespænding.
a) forkert. Osmolaritet er relateret til mængden af opløste partikler, der er indeholdt i et givet volumen opløsningsmiddel.
b) KORREKT. Både vaskemidler og sæber sænker vandets overfladespænding og kaldes generelt overfladeaktive stoffer, fordi molekylerne i disse materialer er placeret mellem vandmolekylerne og reducerer spændingen overfladisk.
c) forkert. Elektroforese er en teknik til at adskille molekyler i henhold til deres ladninger.
d) forkert. Viskositet er en fysisk egenskab, der bestemmer væskens strømningsmodstand.
e) forkert. Osmotisk tryk er en kolligativ egenskab, der svarer til det tryk, der skal udøves på et system for at forhindre osmose i at opstå spontant.
Lær mere om de problemer, der er omfattet af dette nummer:
- Materieegenskaber
- Colligative egenskaber
- Osmotisk tryk
2. Væskes overfladespænding afhænger direkte af interaktionsprocesser mellem molekyler, såsom fx hydrogenbinding. Hvilke af nedenstående stoffer har den højeste overfladespænding?
a) benzen
b) oktan
c) ethylalkohol
d) carbontetrachlorid
e) ethansyre
Korrekt alternativ: e) ethansyre.
a) forkert. Benzen er et carbonhydrid, et ikke-polært molekyle og danner ikke hydrogenbindinger.
b) forkert. Octan er et carbonhydrid, og det er derfor et ikke-polært molekyle, der ikke danner hydrogenbindinger.
c) forkert. Ethylalkohol er en let polær forbindelse, der kan danne hydrogenbindinger, men interaktionen mellem molekylerne er begrænset.
d) forkert. Carbontetrachlorid er en ikke-polær organisk forbindelse og danner derfor ikke hydrogenbindinger.
e) KORREKT. Den carboxylsyrefunktionelle gruppe (-COOH) kan danne hydrogenbindinger med enten oxygenet eller hydroxylbrintet.

Lær mere om de problemer, der er omfattet af dette nummer:
- Molekylers polaritet
- Organiske funktioner
- Kulbrinter
eksperiment på overfladespænding
Se videoen nedenfor med et eksperiment, der viser vandets overfladespænding.



