DET auto-oxi-reduktion eller uforholdsmæssig reaktion er en type redoxreaktion, hvor det samme kemiske element gennemgår oxidation og reduktion. Lad os se på to eksempler på denne type reaktion, og hvordan vi kan afbalancere dem ved hjælp af redox-metoden:
1. eksempel:
VED2- + H+ → NEJ3- + NO + H2O
- Ved at beregne oxidationstal (NOX) for alle atomer og ioner, der er involveret i reaktionen, er det muligt at verificere, hvem der oxiderede og hvem der reagerede:
+3 -2 +1 +5 -2 +2 -2 +1 -2
VED2- + H+ → NEJ3- + NO + H2O
- Bemærk, at kvælstof var den art, der både reagerede og oxiderede:
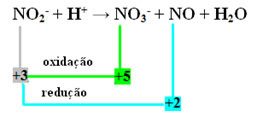
- For at udføre redox-afvejningen af denne reaktion er vi nødt til at relatere NOX til produkterne, ikke reaktanterne:
VED3- = ∆Nox = 5 - 3 = 2
NO = oxNox = 3 - 2 = 1
- Når vi inverterer ∆NOX med koefficienterne, har vi:
VED3- = ∆NOX = 2 → 2 vil være koefficienten for NO
NO = ∆NOX = 1→ 1 vil være koefficienten for NO3-
VED2- + H+ → 1 VED3- + 2 NO + H2O
- Således ved vi allerede, at der er 3 N i produktet, så NO-koefficienten2- bliver 3:
3 NEJ2- + H+ → 1 NEJ3- + 2 NO + H2O
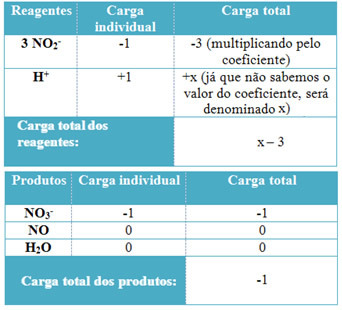
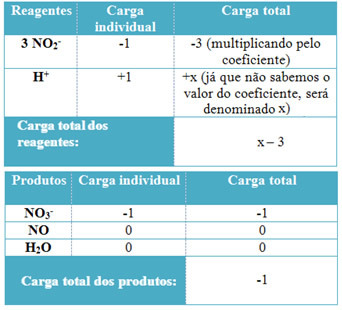
- For at bestemme koefficienterne for H+ og fra H2O, husk at antallet af modtagne elektroner svarer til den samme mængde donerede elektroner; således vil reagensladningen være lig med produktladningen. På denne måde kan vi lave følgende skema:
Stop ikke nu... Der er mere efter reklamen;)
Baseret på denne information har vi, at den samlede ladning af reagenserne er lig med x - 3 og produktet er lig med -1. Som anført skal anklagerne for de to være ens. Da vi allerede har den samlede belastning af produkter, kan vi udføre en simpel beregning for at vide, hvad værdien af x vil være:
x -3 = -1
x = -1 +3
x = 2
Således er koefficienten for H+ er 2 og følgelig den for H2Den bliver 1:
3 NEJ2- + 2 H+ → 1 NEJ3- + 2 NO + 1 H2O
2. eksempel:
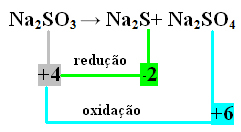
I dette tilfælde var det S, der gennemgik reduktion og oxidation på samme tid. Som tidligere gjort kan vi således relatere NOX til produkterne og invertere deres værdier ved at tildele koefficienterne til dem:
På2 S = ∆Nox = 4 - (-2) = 6 → 6 vil være koefficienten for Na2 KUN4
På2 KUN4= ∆Nox = 6-4 = 2 → 2 vil være koefficienten for Na2 s
På2 KUN3→ 2 På2 Y + 6 På2 KUN4
Da der er 8 svovl i 2. lem, er Na-koefficienten2 KUN3 bliver 8:
8 ind2 KUN3→ 2 ind2 S + 6 ind2 KUN4
Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Selvoxiderende reaktioner"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/reacoes-auto-oxirreducao.htm. Adgang til 28. juni 2021.