Til klassificer et sigma-link, det er vigtigt at vide, hvordan man genkender det i strukturen af et molekyle. Sigma-bindingen er faktisk en kovalent binding opstår, når to ufuldstændige atomorbitaler (med kun en elektron) interpenetrere på samme akse. Et eksempel er når en p-type (helix) orbital interpenetrerer med en anden p-orbital.

p-orbitaler, der interperererer i en p-sigma-binding
I praksis (i øvelser), genkendelsen og klassificeringen af et sigma-link er lavet ud fra strukturformlen af et stof som i nedenstående strukturelle repræsentation:

Strukturel formel af hydrocyansyre
Før du klassificerer et sigma-link, det er nødvendigt at vide, hvordan man genkender det i en strukturformel. Husk bare på dette måder som en kovalent binding er repræsenteret: opkaldet enkel er repræsenteret af et enkelt bindestreg (-), par er repræsenteret af to (=) og linket tredobbelt er repræsenteret af tre (≡). Sigma-bindingen er til stede i en hvilken som helst af de tre repræsentationer af kovalente bindinger som følger:
Enkel: har en sigma-binding;
Par: Af de to links er kun en sigma;
Triple: En af de tre links er sigma.
At vide, hvordan man genkender et sigma-link, er det næste trin at lære at rangere det. Til dette skal vi vide, hvad der er den ufuldstændige kredsløb for hvert atom, der er involveret i bindingen:
H - præsenterer den ufuldstændige s orbital, således at den i klassificeringen er repræsenteret af s.
Ametaler- har en ufuldstændig p-orbital, således at de i klassificeringen er repræsenteret af p med undtagelse af følgende elementer:
Kulstof: Din ufuldstændige orbitale afhænger af typen af hybridisering at han lider. Mulighederne er: sp hybridisering3 (hvor meget laver det fire enkle opkald), sp2 (hvor meget tjener det to enkelt- og en dobbeltbinding) eller sp (hvor meget det udfører to dobbeltbindinger eller en enkelt og en tredobbelt). Således kan kulstof i klassificeringen af en sigma-binding repræsenteres af sp3, sp2 eller sp afhængigt af det opkald, du foretager.
Beryllium:lide sp-type hybridiseringsåledes repræsenteret i klassificeringen ved sp.
Bor:lide sp-type hybridisering2, således, i klassificeringen er det repræsenteret af sp.2.
Med al denne information er den nemmeste del at klassificere sigma-linkene, der findes i en struktur. Lad os se nogle eksempler:
Eksempel 1: sigmaforbindelser i vand

Strukturel formel for vand
Ovenstående strukturformel viser, at vand har to sigma obligationer (to enkle), er de mellem iltet (repræsenteret af s) Det er Brint (repræsenteret af s). Således har vi to sigma-links klassificeret i:
s-p
Eksempel 2: Sigma binder i phosphortrichlorid

Strukturformel af phosphortrichlorid
Ovenstående strukturformel viser, at phosphortrichlorid har tre opkaldsigmas (tre enkle), er de gå ind i fosforet (repræsenteret af s) Det er klor (repræsenteret af s). Således har vi tre sigma-links klassificeret i:
p-p
Eksempel 3: sigma-bindinger i bortrifluorid
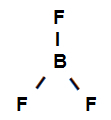
Strukturformel for bortrifluorid
Ovenstående strukturformel viser, at bortrifluorid har tre sigma-links (tre enkle), er de gå ind i boret (repræsenteret af sp2) Det er Fluor (repræsenteret af s). Således har vi tre sigma-links klassificeret i:
p-sp2
Eksempel 4: sigma-bindinger i ethanol
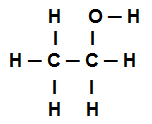
Ethanol strukturformel
Ovenstående strukturformel for ethanol viser det vi har otte opkald sigmas (otte enkle links). Er de:
Én blandt iltet (repræsenteret af p) og hydrogenet (repræsenteret af s). Således klassificeres linket i sigma s-p.
Et af to kulstoffer der kun udfører sigmaforbindelser (og derefter repræsenteret af sp3). Således er linket klassificeret i sp3-P3.
En blandt kulstofferne (repræsenteret af sp3) og iltet (repræsenteret af s). Således klassificeres sigma-linket i p-sp3.
fem mellem kulstof (repræsenteret af sp3) og hydrogenet (repræsenteret af s). Således klassificeres alle fem i s-sp3.
Eksempel 5: Sigma-bindinger i dichlorethen

Dichlorethen strukturel formel
Ovenstående strukturformel for dichlorethen viser, at vi har tilstedeværelsen af fem sigma-links (de fire enkeltbindinger og en af dobbeltbindingerne). Er de:
Et af to kulstoffer der udfører to enkelt- og en dobbeltbinding (og derefter repræsenteret af sp2). Således klassificeres sigma-linket i sp2-P2.
Fire er mellem kulstof(repræsenteret af sp2)og hydrogenet (repræsenteret af s). Således klassificeres alle fire i s-sp2.
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/classificacao-uma-ligacao-sigma.htm

