DET hydrolysekonstant (Kh) henviser til en kemisk balance etableret ved hydrolyse af et salt (kemisk reaktion, der involverer et opløseligt salt og vand).
Som konstanten i enhver anden ligevægt er udtrykket af hydrolysekonstant er konstrueret ud fra produktet af produktkoncentrationer divideret med produktet af reagenskoncentrationer som følger:
Kh = [Produkter]
[reagenser]
Arbejde med hydrolysekonstanten involverer viden om tre vigtige fænomener:
- Dissociation af salte;
- Vandionisering;
- Salthydrolyse.
Dissociation af salte
Når et opløseligt salt tilsættes til vand, adskiller det sig og frigiver en anden kation end hydronium (H +) og en anden anion end hydroxyl (OH-).

For at minde dig om, når et salt er eller ikke er opløseligt i vand, Klik her og studer saltopløselighedstabellen.
vandionisering
Vand er et stof, der naturligt gennemgår fænomenet selvionisering, det vil sige, det producerer en hydroniumkation og en hydroxylanion.
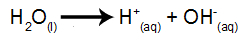
vandioniseringsligning
hydrolyse af et salt
Som et opløseligt salt frigiver det ioner i vandet, og vandet gennemgår ionisering og producerer det
ioner i midten kan reaktionen (hydrolyse) mellem saltionerne og vandionerne finde sted. Når denne reaktion opstår, er de mulige interaktioner:- Kation af saltet med anionen af vand (dannelse af en base);
- Saltion med kation af vand (dannelse af salt);
Ovenstående interaktioner vil kun forekomme, hvis den dannede base eller syre er svag.
Se et eksempel på hydrolyse af et salt:
→ Hydrolyse af ammoniumhypochlorit (NH4ClO)
Når ammoniumhypochlorit tilsættes til vand, opløses det og dissocieres og frigiver ammoniumkationioner (NH4 +) og hypochloritanionen (ClO-):

Ligning, der viser ionerne frigivet i dissociationen af ammoniumhypochlorit
Da vand, når det gennemgår ionisering, producerer H + og OH-, har vi i løsningen to kationer og to anioner, som kan reagere. NH4 + -kationen reagerer kun med OH-anionen, fordi den danner en svag base (NH4OH). ClO-anionen reagerer kun med H + kationen, fordi den danner en svag syre (HClO).

Ammoniumhypochlorit hydrolyse ligevægt ligning
Konstruktion af ekspressionen af hydrolysekonstanten
Konstruktionen af hydrolysekonstanten for et salt afhænger udelukkende af hydrolyseligningen for dette salt. Hydrolysen af ammoniumhypochlorit, for eksempel arbejdet på i den forrige artikel, genererede følgende ligning:

Ammoniumhypochlorit hydrolyse ligevægt ligning
Hvordan man bygger udtrykket af hydrolysekonstant tager produkter og reagenser i betragtning, vil udtrykket af konstanten være:
Kh = [HClO]. [NH4OH]
[ClO -]. [NH4 +]
BEMÆRK: Vand deltager ikke i ligningen, fordi det er et flydende reagens, og også fordi det er det grundlæggende middel til forekomst af hydrolyse, dvs. det er konstant.
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm
