O benzen er en organisk forbindelse klassificeret som en aromatisk carbonhydrid. Det bruges i vid udstrækning som råmateriale i industrier, i laboratorieprocesser, i stålvirksomheder og i petrokemiske industrier til olieraffinering.
Læs også: Methan - den mindste og enkleste af kulbrinter
Formel
Benzen er en forbindelse med molekylær formel Ç6H6og hvem har en ekstremt stabil strukturl. Den strukturelle formel for benzen er repræsenteret som følger:
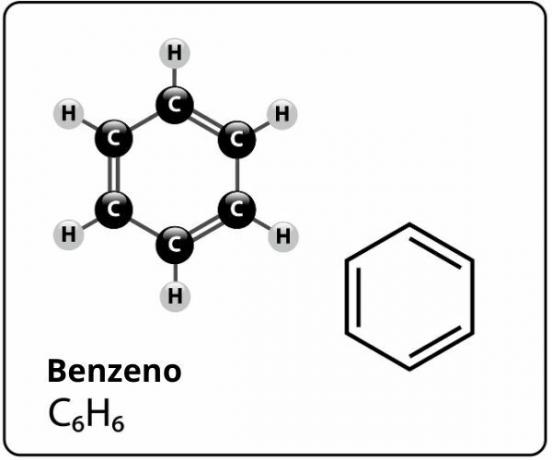
Hvem foreslog denne struktur til benzen med seks kulstofatomer bundet sammen med alternerende dobbeltbindinger, danner en sekskant og har knyttet til hvert af dem et atom af hydrogen, det var den tyske kemiker Friedrich August Kekulei 1866.
Benzen gennemgår et fænomen kaldet resonans, hvor elektronerne i bindingerne mellem kulstofferne adskiller sig i deres position. Af denne grund kan benzen repræsenteres som følger:
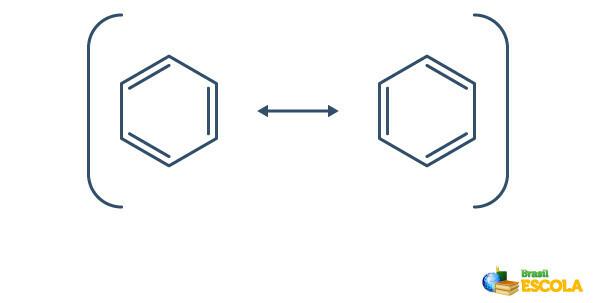
Den egentlige struktur af benzen er et mellemled mellem de ovenfor viste resonansstrukturer. Dette betyder ikke, at benzen undertiden vises i en form, undertiden i en anden, og heller ikke at begge former eksisterer på samme tid. Vi repræsenterer benzen som følger:
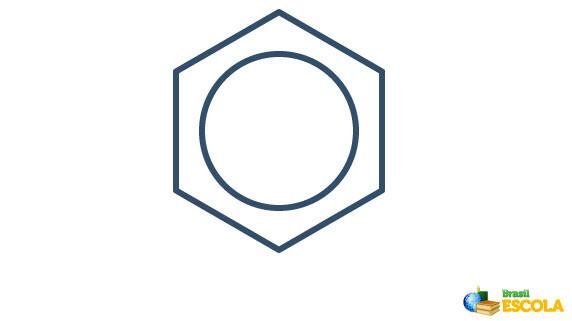
Cirklen inde i sekskanten repræsenterer resonansen mellem elektronerne i bindingerne.
Stop ikke nu... Der er mere efter reklamen;)
Funktioner
- Benzen er en væske farveløs, brandfarlig det er almindeligt behagelig aroma egenskab.
- Molekylær formel: C6H6.
- Molær masse: 78,11 g / mol.
- Massefylde: 0,876 g / cm3.
- Smeltetemperatur: 5,5 ° C.
- Kogetemperatur: 80,1 ºC - dens lave kogetemperatur forklarer dens høje flygtighed (let at fordampe).
Benzen er en giftigt stof og dens dampe kan forårsage svimmelhed, hovedpine og besvimelse.
Læs også:Kulilte - ekstremt giftig, farveløs og lugtfri gas
Anvendelser og toksicitet af benzen
benzen er hovedsageligt brugt som råmateriale i industrier til produktion af andre stoffer, såsom plast og polymerer baseret på styren, harpikser, klæbemidler, nylon, gummi, smøremidler, pesticider osv.
Benzen er blevet erstattet, hovedsageligt i laboratorier, af toluen, som har polaritet og opløselighed svarer til benzen, men det er mindre giftigt og med en højere kogetemperatur.
Benzen er inden for gruppen af kemiske stoffer, der betragtes som kræftfremkaldende stoffer, der forårsager skader på knoglemarv og leukæmi, når de udsættes langvarigt i høje koncentrationer. På kort sigt kan benzen forårsage svimmelhed, døsighed, hurtig hjerterytme, kramper og besvimelse.
Da det er en flygtig væske, frigiver benzen let gasser, og derfor forekommer benzenforurening hovedsageligt gennem luftvejene.
Hvor findes benzen?
Det meste af benzen, der frigives i miljøet resultater fra menneskelig handling, hovedsagelig inden for industrielle aktiviteter, men det kan også frigives som et biprodukt af brande og vulkanske aktiviteter.
benzen er et af de indgående stoffer i Olie og er til stede i benzin, der frigives i atmosfæren ved at brænde bilbrændstoffer. Desuden findes det også i læskedrikke og cigaretter.

Polaritet
Benzen er en ikke-polært molekyle, ligesom alle andre Kulbrinter og derfor gaver meget lav opløselighed i vand (0,8 g / l ved 15 ° C). I nogle laboratorieprocedurer anvendes benzen som et organisk opløsningsmiddel til ikke-polære stoffer.
Nomenklatur
Der er en regel, der kun anvendes til nomenklaturen for aromatiske forbindelser, det vil sige dem, der har benzen i deres struktur. Denne regel er opdelt i to tilfælde, der afhænger af mængden af radikaler, der er bundet til benzenringen.
1. SAG: når der kun er en radikal knyttet til benzenringen, gives navnet efter følgende regel:
RADIKALT NAVN + BENZEN
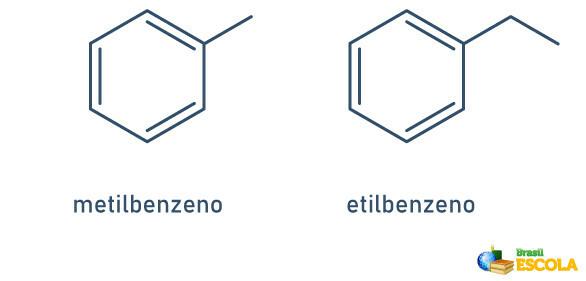
Bemærk, at det ikke er nødvendigt at angive stilken.
2. SAG: når der er mere end en radikal knyttet til benzen, følger navnet følgende regel:
RADIKAL POSITION + RADIKALT NAVN + BENZEN
Se eksemplet:

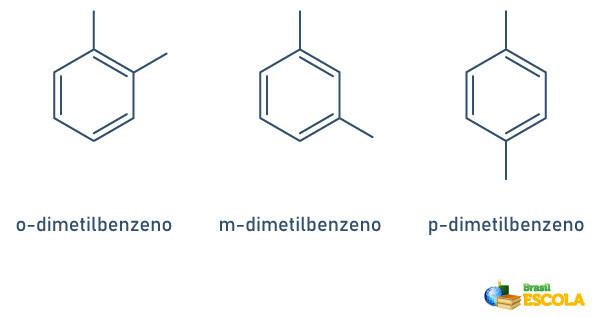
Når benzenringen kun har to tilknyttede radikaler, er der en specifik nomenklatur, der kan bruges:
- 1,2 eller ortho (o);
- 1.3 eller mål (m);
- 1.4 eller til (p).
Se eksemplerne:
Læs også: Ammoniumnitrat - stærkt reaktiv forbindelse anvendt til fremstilling af sprængstoffer
Nysgerrigheder
- Benzen er et ekstremt kræftfremkaldende stof, der klassificeres af Det Internationale Agentur fra kræftforskning i gruppe 1 sammen med tobak, dieselrøg og kød behandlet.
- Der er flere regulerende organer, der begrænser eksponering og emission af benzen i forskellige lande. I Brasilien er denne rolle Anvisas ansvar.
- Før benzin blev kendt til dets risici, blev det brugt i kosmetik, såsom aftershave, på grund af dets behagelige lugt.
Af Victor Ricardo Ferreira
Kemilærer
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FERREIRA, Victor Ricardo. "Benzen"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/benzeno.htm. Adgang til 27. juni 2021.
Kemi

Aromatiske forbindelser, arener, polaritet, uopløselige, opløselige, ikke-polære opløsningsmidler, ether, carbontetrachlorid, kulbrinter, insekticider, farvestoffer, opløsningsmidler, sprængstoffer, kræftfremkaldende stoffer, toluen, methylbenzen, lægemidler, lim skomager.


