En af de største udfordringer for enhver, der lærer kemi, kaldes elektronisk distribution. Det, vi vil præsentere i denne sammenhæng, kan i høj grad lette dine studier relateret til den elektronkonfiguration, der er foreslået af videnskabsmand Linus Pauling.
Det maksimale antal elektroner, der passer ind i hvert lag eller energiniveau, gives gennem tabellen:
Energiniveaulag Maksimalt antal elektroner
1. K 2
2. L 8
3. M 18
4. N 32
5 ° O 32
6. P 18
7. Q 8
Den stigende orden af energi på underniveauerne er rækkefølgen i diagonalernes rækkefølge. Linus Pauling-diagrammet er vist nedenfor:
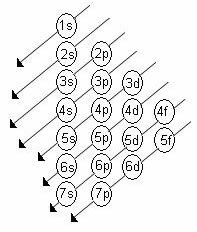
Grundlæggende regler:
1. Elementets atomnummer (Z) i neutral tilstand angiver antallet af elektroner, der skal distribueres. Dette tal er repræsenteret i den nederste venstre del af elementets symbol.
2. Brug Pauling-diagrammet til at distribuere elektronerne fra top til bund under hensyntagen til den stigende orden af energi (orienteret ved pilens retning).
3. Fyld underniveauerne med det maksimale niveau af elektroner. Hvis et givet underniveau kun indeholder 6 elektroner, må du ikke overstige det beløb.
4. Kontroller antallet af elektroner ved at tilføje dem i hvert underniveau.
Lad os omsætte det i praksis?
Fordel elektronerne i jernatomet (Z = 26).
Hvis atomnummeret er 26, betyder det, at der i det normale jernatom er 26 elektroner. Ved anvendelse af Pauling-diagrammet har vi:

Af Líria Alves
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm


