Forbrænding er en eksoterm kemisk reaktion mellem to regenter, brændstof og oxidator, hvor energi frigives i form af varme.
- Brændstof: Det er det oxiderbare stof, der er ansvarligt for at forbrænde forbrændingen. Eksempler: benzin, træ, kogegas, alkohol og diesel.
- oxiderende: Det er stoffet, der forbedrer forbrændingen. I de fleste tilfælde er oxidatoren ilt-O-gas2.
Forbrænding finder kun sted i nærværelse af brændstof og oxidationsmiddel. Således afsluttes eller afbrydes det kun på grund af manglen på et af disse reagenser.
Forbrænding er meget almindelig i hverdagen, den er til stede i afbrænding af madlavningsgas, bilbrændstoffer, stearinlys, træ, papir, blandt andre.
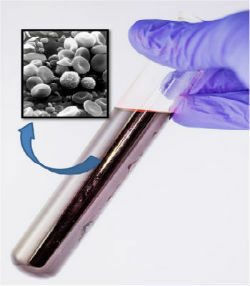
 Brændende træ er et eksempel på forbrænding
Brændende træ er et eksempel på forbrænding
Typer
Organiske forbindelser har to typer forbrænding, komplette og ufuldstændige.
Komplet forbrænding
Komplet forbrænding er den, der har nok ilt til at forbruge brændstoffet. Det præsenterer som produkter CO2 (Carbondioxid) og H2O (Vand).
Komplet forbrænding har større frigivelse af varme.
Eksempler:
a) Fuldstændig forbrænding af ethanol (C2H6O):
Ç2H6O + O2 → CO2 + H2O
Når du afbalancerer reaktionen:
Ç2H6O + 3 O2 → 2 CO2 + 3 H2O
I denne reaktion var iltmængden tilstrækkelig til at forbruge al methanol og stammer fra CO-produkterne2 og H2O.
b) Fuldstændig forbrænding af metan (CH4):
CH4 + O2 → CO2 + H2O
CH4 + O2 → CO2 + 2 H2O
Ufuldstændig forbrænding
Ved ufuldstændig forbrænding er der ikke nok ilt til at forbruge brændstoffet fuldstændigt.
Den har to typer produkter: CO (Carbonmonoxid) eller sod (C), stoffer, der er giftige for miljøet og sundhedsskadelige.
Ufuldstændig forbrænding har mindre frigivelse af varme.
Eksempler:
a) Ufuldstændig forbrænding af ethanol:
Ç2H6O + 2 O2 → 2 CO + 3 H2O = produktion af CO og H2O.
Ç2H6O + O2 → 2 C + 3 H2O = produktion af sod og H2O.
Bemærk, at der mellem de to reaktioner er et fald i iltmængden, dette repræsenterer en mindre mængde frigivet varme.
b) Ufuldstændig forbrænding af metan:
CH4 + 3/2 O2 → CO + 2 H2O
CH4 + O2 → C + 2 H2O
Læs også:
- Oxidation
- Kemiske reaktioner
- Endotermiske og eksoterme reaktioner
- termokemi
Forbrændingshalppi
Entalpi (H) af forbrænding eller forbrændingsvarme er den energi, der frigøres ved forbrænding af 1 mol brændstof under standardtilstand (temperatur: 25 ° C; Tryk: 1 atm).
Fordi forbrænding er en eksoterm reaktion, vil entalpiændringen (∆H) altid have en negativ værdi.
Forbrændingsentalpi kan beregnes ved hjælp af følgende formel:
ΔH = HProdukter - Hreagenser
Spontan forbrænding
Spontan forbrænding er den, der finder sted uden eksistensen af en ekstern brændbar kilde.
Dette sker med nogle materialer, der er i stand til at akkumulere meget varme inde i dem, hvilket øger hastigheden af kemiske reaktioner. Denne tilstand øger temperaturen på materialet, indtil forbrændingen finder sted.
Der er stadig bevis for spontan menneskelig forbrænding (CHE), hvor kroppen forbrænder sig uden indflydelse fra eksterne kilder.
Den første registrering af denne sag ville være sket med en kvinde, mens hun sov, i 1663. Andre lignende tilfælde var også relateret til spontan menneskelig forbrænding.
Imidlertid forsøger videnskaben stadig at forstå, hvordan processen finder sted i den menneskelige krop. I øjeblikket er der kun få teorier, der forklarer fænomenet.
Se også: Ild