Pufferopløsningen er normalt en blanding af en svag syre og saltet af den syre eller en svag base og saltet af den base. Denne opløsning er beregnet til at forhindre, at meget store variationer i pH eller pOH i en opløsning opstår.
Nedenfor er nogle eksempler på bufferløsninger:
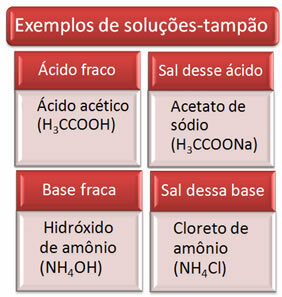
Effektiviteten af bufferopløsningen kan ses i vores blod, hvor der, selv med tilsætning af syre eller base i små mængder til blodplasma, praktisk talt ikke er nogen ændring i dets pH.
Hvordan sker dette, i betragtning af at hvis vi tilsætter syrer eller baser til vand, ændres dets pH hurtigt?
Menneskeligt blod er et lidt grundlæggende buffersystem, det vil sige, det er en bufret væske: dens pH forbliver konstant mellem 7,35 og 7,45. En af de mest interessante og vigtige buffere i blodet er dannet af kulsyre (H2CO3) og med saltet af denne syre, natriumbicarbonat (NaHCO3).
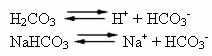
Der er således følgende arter i denne bufferopløsning:
H2CO3: til stede i store mængder, da det er en svag syre, lider den kun lidt af ionisering;
H
HCO3-: også til stede i store mængder fra ionisering af H2CO3 og saltdissociation (NaHCO3);
På+: fra ioniseringen af NaHCO3;
Hvis der tilsættes en lille syrekoncentration til denne opløsning, vil dens ionisering forekomme og generere H-kationer+, som vil reagere med HCO-anioner3- til stede i mediet med oprindelse ikke-ioniseret kulsyre. Der er ingen ændring i pH.
Hvis der tilføjes en base, genereres OH-anioner-. Disse ioner kombineres med H-kationerne+fra ionisering af H2CO3. Således er OH-anionerne- neutraliseres, idet mediets pH opretholdes.
Ud over denne nævnte bufferopløsning er der også to andre til stede i blodet, som er: H2STØV4/HPO42- og nogle proteiner. Hvis der ikke var sådanne bufferopløsninger i blodet, kunne pH-området blive alvorligt skævt. Hvis blodets pH stiger over 7,8, kaldes det alkalose. Hvis pH falder for meget, under 6,8, vil det være en tilstand af acidose. Begge er farlige forhold, der kan føre til døden.

Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/solucaotampao-no-sangue-humano.htm