osmoskopi er fælles ejerskab (de andre er tonoskopi, ebullioskopi og kryoskopi) som studerer forekomsten af osmose mellem to opløsninger med forskellige koncentrationer, hvoraf den ene er mere koncentreret end den anden.
Bemærk: Colligative egenskaber opstår, når en ikke-flygtig opløsningsmiddel sættes til et opløsningsmiddel.
Såsom osmoskopi studere osmose, er det vigtigt at vide Hvad er dette fænomen. Til dette vil vi bruge nedenstående løsninger, der er adskilt af en semipermeabel membran:
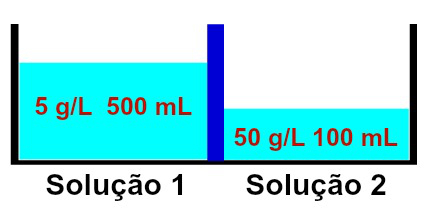
Repræsentation af løsninger, der har forskellige koncentrationer
Det observeres, at opløsning 1 indeholder en koncentration på 5 g / L og et volumen på 500 ml, mens den opløsning 2 har en koncentration på 50 g / L og et volumen på 100 ml, adskilt af en membran semipermeable. Opløsning 2 er mere koncentreret end opløsning 1, og derfor skal der forekomme osmose mellem dem.
Osmose skal nødvendigvis ske fra opløsning 1 til opløsning 2, da opløsning 1 er mindre koncentreret. Under denne forekomst krydser en del af opløsningsmidlet den semipermeable membran, hvilket gør opløsningens volumen 2 øge og volumen af opløsning 1 falde, indtil begge opløsninger begynder at have den samme koncentration, det vil sige isotoni.

Ændring i højde af opløsning 1 og 2 på grund af forekomsten af osmose
Bemærk: Isotoniske medier er dem, hvis koncentration er lig.
Ifølge osmoskopiosmose finder sted, fordi opløsningsmidlets maksimale damptryk i den mindre koncentrerede opløsning er større end opløsningsmidlets i den mere koncentrerede opløsning. Hvis vi nu vil forhindre forekomsten af osmose, skal du bare udøve pres på den mest koncentrerede opløsning:
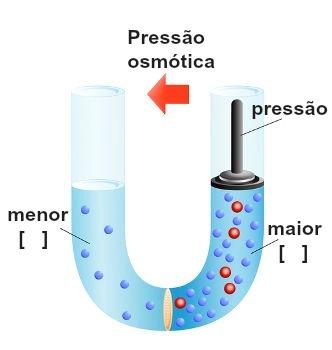
Repræsentation af udførelsen af pres på den mest koncentrerede løsning
Dette tryk, der udøves på den mest koncentrerede opløsning til at blokere eller endog reversere osmose, kaldes osmotisk tryk og er repræsenteret af symbolet π. Den skal være direkte proportional med koncentrationen af opløsningen.
Mulige fortolkninger af osmotisk tryk
I henhold til konklusionerne fra osmoskopi, hver opløsning har et osmotisk tryk, da dette er relateret til koncentrationen, en egenskab der er til stede i enhver opløsning.
Når vi sammenligner et medium eller en løsning med et andet, kan vi bruge følgende udtryk:
Hypertonisk: når det ene medium har et osmotisk tryk større end det andet;
hypotonisk: når det ene medium har et osmotisk tryk lavere end det andet
Isotonisk: når de to medier eller opløsninger har det samme osmotiske tryk.
Når man sammenligner det osmotiske tryk af to opløsninger A og B, repræsenteret af πDET og πB, det kan vi godt sige :
Hvis det osmotiske tryk på A og B er ens, vil midlerne eller opløsningerne være isotoniske:
πDET = πB
Hvis det osmotiske tryk på A er større end det osmotiske tryk på B, vil medium A være hypertonisk i forhold til B:
πDET> πB
Hvis det osmotiske tryk af B er lavere end det osmotiske tryk af A, vil medium B være hypotonisk i forhold til B:
πB< πDET
Formel til beregning af osmotisk tryk
π = M.R.T
I denne formel:
π = er det osmotiske tryk
M = er koncentration i mol / l
R = er den generelle gaskonstant (0,082 for tryk i atm; 62,3 for tryk i mmHg)
T = temperatur i Kelvin
Da koncentrationen i mol / L har en bestemt formel, som vist nedenfor:
M = m1
M1.V
Vi kan erstatte det i den osmotiske trykformel:
π = m1.R.T
M1.V
Bemærk: Hvis det opløste stof, der er til stede i opløsningen, er ionisk, skal vi bruge Van't Hoff-korrektionsfaktor i) i udtrykket af den osmotiske trykberegning:
π = M.R.T.i
Eksempel på osmotisk trykberegning
Eksempel: (UF-PA) En opløsning indeholdende 2 mg af et nyt antibiotikum i 10 ml vand ved 25 ºC producerer et osmotisk tryk på 0,298 mmHg. Så den molekylære masse af dette antibiotikum er omtrent:
a) 3000
b) 5200
c) 7500
d) 12500
e) 15300
Dataene fra øvelsen var:
π = 0,298 mmHg
T = 25 OC eller 298 K (efter tilsætning med 273)
m1 = 2 mg eller 0,002 g (efter opdeling med 1000)
V = 10 ml eller 0,01 l (efter opdeling med 1000)
R = 62,3 mmHg
For at løse denne øvelse skal du blot anvende de tilgængelige data i udtrykket til beregning af det osmotiske tryk som følger:
π = m1.R.T
M1.V
0,298 = 0,002.62,3.298
M1.0,01
0.298.M1.0,01 = 37,1308
0,00298.M1 = 37,1308
M1 = 37,1308
0,00298
M1 = 12460 u
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-osmoscopia.htm
