Jo højere temperaturen er, desto større er reaktionshastigheden.
Dette kan let ses i mange situationer i vores daglige liv som i følgende eksempler:
- Når vi vil bremse nedbrydningsreaktionen for en mad, sænker vi temperaturen og placerer den i køleskabet.

- Hvis vi vil fremskynde madvarens reaktion, skal du bare lægge den i en gryde. tryk, som med stigende tryk også øger kogetemperaturen for det flydende vand, hvori mad er;

- Brande er generelt ødelæggende, fordi temperaturen i miljøet stiger, hvilket medfører en forøgelse af forbrændingsreaktionens hastighed;
- At bremse metaboliske kemiske processer og mindske chancerne for hjerneskade pga iltmangel, nogle operationer udføres ved at sænke patientens kropstemperatur og nå rundt 15 ° C;
- Hvis vi lægger en brusetablet i et glas varmt vand og en anden i et glas koldt vand, opløses den første meget hurtigere.
Men hvad forklarer temperaturens direkte proportionale indflydelse på reaktionshastigheden?
Dette skyldes, som forklaret i teksten “Betingelser for forekomst af kemiske reaktioner
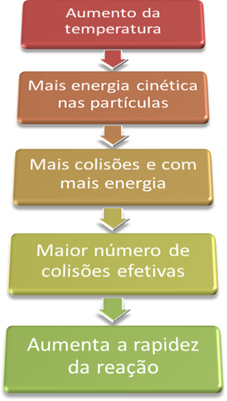
”For at en reaktion kan fortsætte, er det nødvendigt at tilfredsstille nogle betingelser, såsom at partiklerne de skal kollidere effektivt og med den krævede minimumsenergi, der kaldes aktiveringsenergi.Når vi således øger temperaturen i systemet, øger vi også omrøringen af de reagerende partikler og giver dem mere kinetisk energi. Med dette vil der forekomme flere kollisioner og med mere energi, hvilket øger mængden af partikler, der vil reagere og dermed øger reaktionshastigheden.
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/temperatura-velocidade-das-reacoes.htm
