Du nitroforbindelser er karakteriseret ved tilstedeværelsen af følgende funktionelle gruppe:
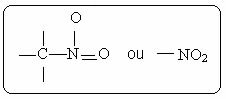
Blandt dets derivater er den bedst kendte nitrobenzen, som er en gul, giftig, vanduopløselig, tæt væske, der bruges som opløsningsmiddel for organiske stoffer.
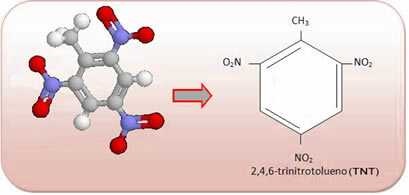
Disse forbindelser er meget reaktive, så de er meget udbredt som sprængstoffer. Nogle velkendte eksempler er 2-methyl-1,3,5-trinitrobenzen eller 2,4,6-trinitrotoluen (TNT) eller 2,4,6-dinitrotoluen (DNG) og trinitroglycerin (TNG), der udover at være sprængstof også bruges som koronar karudvidelse ved risiko for infarkt.
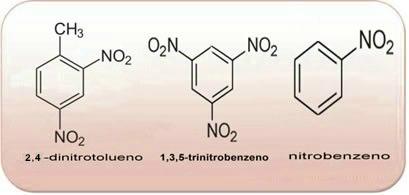
Ovenstående forbindelser er alle aromatiske, jo større mængden af NO2 i sine molekyler, jo mere eksplosiv vil den være. Deres præparater og egenskaber er meget forskellige fra alifatiske nitroforbindelser. Nitroalkaner er farveløse, polære væsker, også uopløselige i vand og bruges i organiske synteser, som mellemprodukter og som opløsningsmidler.
Nomenklaturen for nitroforbindelser følger nedenstående regel, etableret af International Union of Pure and Applied Chemistry (IUPAC):

Således har vi følgende navne for nitroforbindelsesstrukturerne nedenfor:
H3Ç__VED2: nitromethan
H3Ç__CH2__VED2: nitroethan
H3Ç__CH2__ CH2__VED2: 1- nitropropan
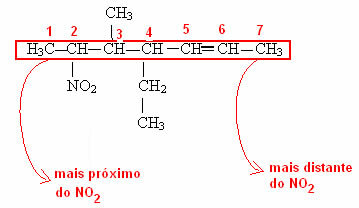
Bemærk i det sidste eksempel, at det var nødvendigt at nummerere, hvor den funktionelle gruppe af kulstofkæden kommer fra. Denne nummerering udføres altid med start i den nærmeste ende af den funktionelle gruppe. Se, hvordan dette gøres i eksemplet nedenfor:
Af Jennifer Fogaça
Uddannet i kemi
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/nitrocompostos.htm
