Organisk kemi er et bredt område inden for kemi, der studerer kulstofforbindelser.
Viden om organisk kemi kontaktes på flere måder, og når vi tænker over det, har vi sammensat foreslåede øvelser, optagelseseksaminer og Enem-spørgsmål til dig for at teste din viden.
Brug også resolutionens kommentarer til at lære endnu mere om emnet.
Foreslåede øvelser
Spørgsmål 1
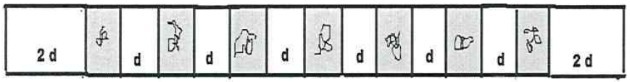
Se på de organiske forbindelser nedenfor og identificer de organiske funktioner i henhold til de fremhævede funktionelle grupper. Derefter skal du navngive stofferne.
Svar:
a) Organisk forbindelse: ethanol
- organisk funktion: alkohol
- Generel formel: R — OH
- Identifikation: hydroxyl (OH) bundet til carbonkæden
b) Organisk forbindelse: ethansyre.
- Organisk funktion: carboxylsyre
- Generel formel: R — COOH
- Identifikation: carboxylradikal (COOH) bundet til carbonkæden
c) Organisk forbindelse: trimethylamin
- Organisk funktion: amin (tertiær)
- Generel formel:
- Identifikation: kvælstof bundet til tre carbonkæder
spørgsmål 2
I organisk kemi genkendes forbindelser af kæderne dannet af kulstof og brint. Imidlertid kan andre grundstoffer være en del af den kemiske struktur af disse forbindelser, såsom ilt.
Vælg alternativet, hvor de to organiske forbindelser har iltede organiske funktioner.
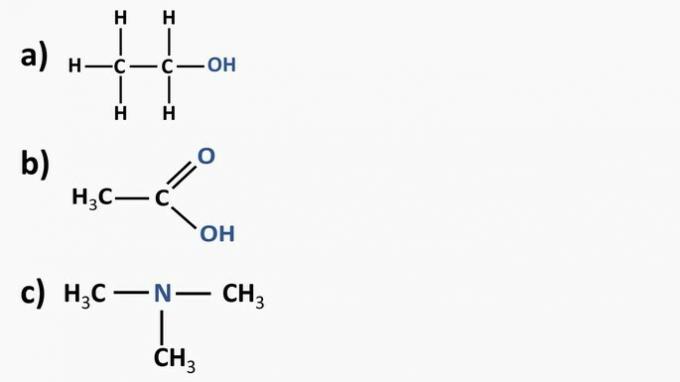
a) chloroform og ethylmethaneat
b) propanol og propansyre
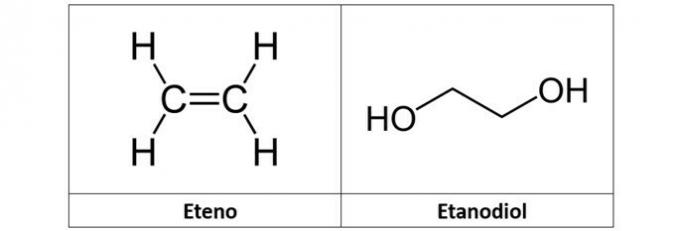
c) ethen og etandiol
d) ethanamid og benzen
Korrekt svar: b) propanol og propansyre
a) forkert. Vi har chloroform (CHCl3som er et alkylhalogenid, og ethylmethanoatesteren (C3H6O2), som indeholder ilt i sin struktur.
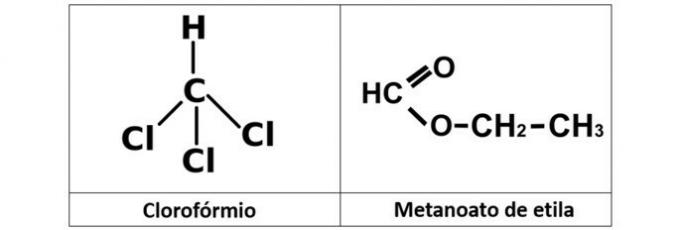
b) KORREKT. I dette alternativ har vi to forbindelser, der har iltede organiske funktioner. Propanol (C3H8O) er en alkohol dannet af tre carbonatomer. Propansyren (C3H6O2er en carboxylsyre.
c) forkert. Ethylenet (C2H4), også kaldet ethylen, er et alken-type carbonhydrid. Allerede etandiol (C2H6O2) er en alkohol med to hydroxyler i sin struktur.
d) forkert. Ethanamid (C2H5NO) er et amid, og benzen er et aromatisk carbonhydrid og er derfor kun dannet af carbon og hydrogen.

spørgsmål 3
Se på strukturen af den organiske forbindelse nedenfor og kontroller de sande udsagn.

(01) Forbindelsen har en organisk nitrogenfunktion.
(02) Det er en primær amin, da den kun er knyttet til et hydrogen.
(03) Navnet på forbindelsen er diethylamin.
Ret svar:
(01) KORREKT. Den organiske nitrogenfunktion, der er til stede i forbindelsen, er amin.
(02) FORKERT. Det er en sekundær amin, da nitrogen er bundet til to carbonkæder.
(03) FORKERT. Forbindelsens navn er dimethylamin, da der er to methylradikaler bundet til nitrogen.
spørgsmål 4
Eugenol, et medlem af phenylpropanoidfamilien, er en aromatisk organisk forbindelse, der er til stede i nelliker, et krydderi brugt siden oldtiden.

Overhold strukturens formel for forbindelsen og identificer de tilstedeværende organiske funktioner.
a) Alkohol og ether
b) Phenol og ether
c) Alkohol og ester
d) Phenol og ester
e) Alkohol og kulbrinte
Korrekt alternativ: b) Phenol og ether.
Eugenol har iltede organiske funktioner i sin kæde, dvs. ud over carbon- og hydrogenatomer er ilt et heteroatom til stede.
Den organiske phenolfunktion er karakteriseret ved hydroxyl (-OH) bundet til en aromatisk ring. I etherfunktionen er ilt placeret mellem to carbonkæder.
spørgsmål 5
EDTA, hvis fulde navn er ethylendiamintetraeddikesyre, er en organisk forbindelse med mange anvendelser. Dens evne til at binde metalioner gør det til et chelateringsmiddel, der er meget udbredt både i laboratoriet og industrielt.
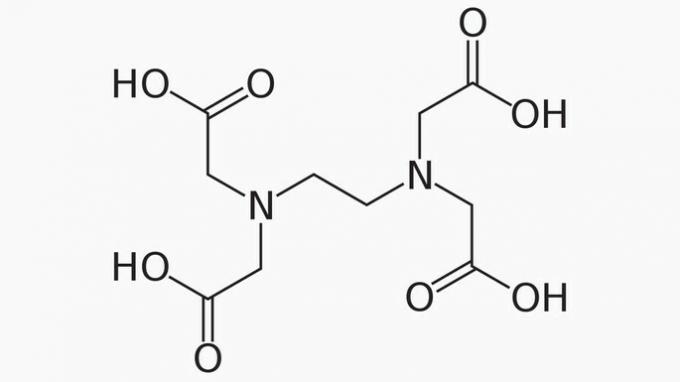
Om EDTA er det korrekt at anføre, at kulstofkæden er:
a) Åben, homogen og umættet.
b) Lukket, heterogent og mættet.
c) Åben, heterogen og umættet.
d) Lukket, homogent og mættet.
e) Åben, heterogen og mættet.
Korrekt svar: e) Åben, heterogen og mættet.
EDTA-kæden er klassificeret i:
ÅBEN. Ifølge arrangementet af carbonatomer i strukturen af EDTA kan vi se, at på grund af tilstedeværelsen af ender åbnes forbindelseskæden.
HETEROGEN. Ud over kulstof- og hydrogenforbindelser har carbonkæden nitrogen- og ilt-heteroatomer.
MÆTTET. Bindingerne mellem kulstofatomer er mættede, da kæden kun har enkeltbindinger.
Lær mere på: Organisk kemi.
optagelsesprøve spørgsmål
Spørgsmål 1
(UFSC) Overhold de ufuldstændige organiske strukturer og identificer de korrekte element (er):
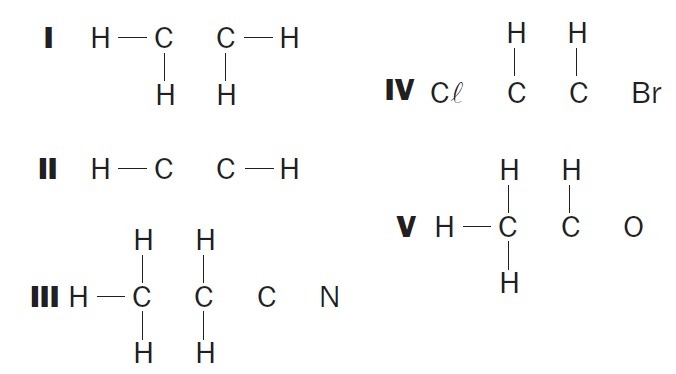
(01) Struktur I mangler en enkelt binding mellem kulstofatomer.
(02) Struktur II mangler en tredobbelt binding mellem kulstofatomer.
(03) Struktur III mangler to enkeltbindinger mellem kulstofatomer og en tredobling mellem kulstof og nitrogenatomer.
(04) Struktur IV mangler to enkeltbindinger mellem kulstofatomer og halogener og en dobbeltbinding mellem kulstofatomer.
(05) Struktur V mangler en enkelt binding mellem kulstofatomer og en enkelt binding mellem kulstof og iltatomer.
Korrekte alternativer: 02, 03 og 04.
Ud over kulstof, et obligatorisk kemisk element i organiske forbindelser, kan andre grundstoffer være til stede i strukturer og bundet af kovalente bindinger, hvor elektroner deles.
Elementernes valens bestemmer antallet af obligationer, der kan dannes, som vist i nedenstående tabel.
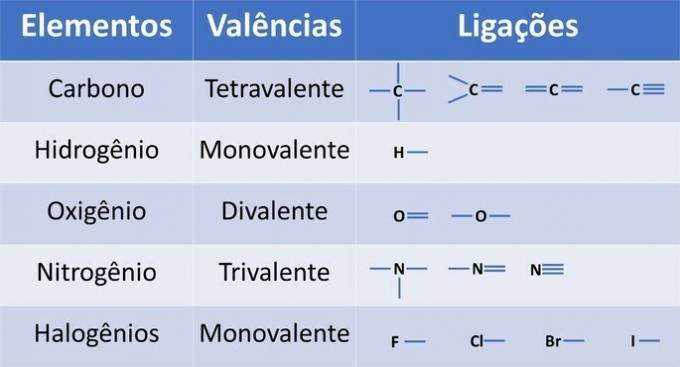
Fra disse oplysninger har vi:
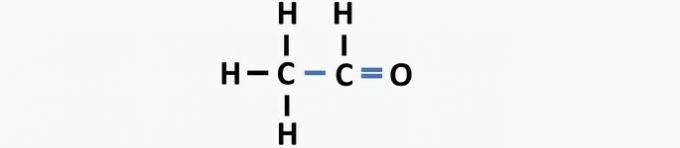
(01) FORKERT. Strukturen mangler en dobbeltbinding mellem carbonatomer til dannelse af etenforbindelsen.
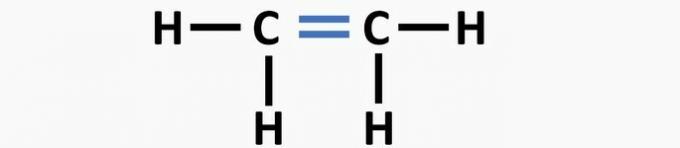
(02) KORREKT. Strukturen mangler en tredobbelt binding mellem carbonatomer for at danne ethyneforbindelsen.
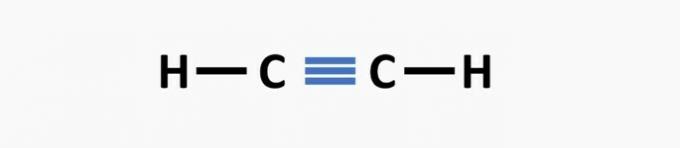
(03) KORREKT. Strukturen mangler enkeltbindinger mellem carbonatomer og tredobbelte bindinger mellem kulstof og nitrogen til dannelse af forbindelsen propanenitril.
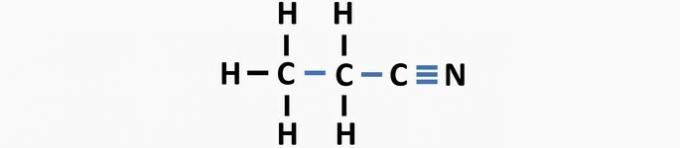
(04) KORREKT. Strukturen mangler enkeltbindinger mellem kulstof og halogen og dobbeltbindinger mellem carbonatomer for at danne dichlorethenforbindelsen.
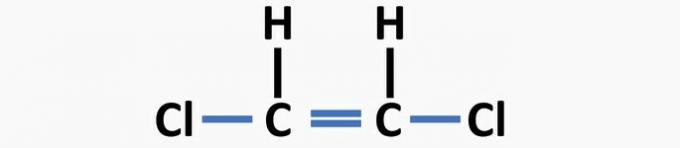
(05) forkert. Strukturen mangler en enkeltbinding mellem carbonatomer og en dobbeltbinding mellem kulstof og ilt til dannelse af ethanalforbindelsen.
spørgsmål 2
(UFPB) Strukturen af den organiske forbindelse med molekylformel C5H8Hvad der præsenterer en forgrenet, umættet, heterogen og alicyklisk kæde er:

Korrekt alternativ: d.
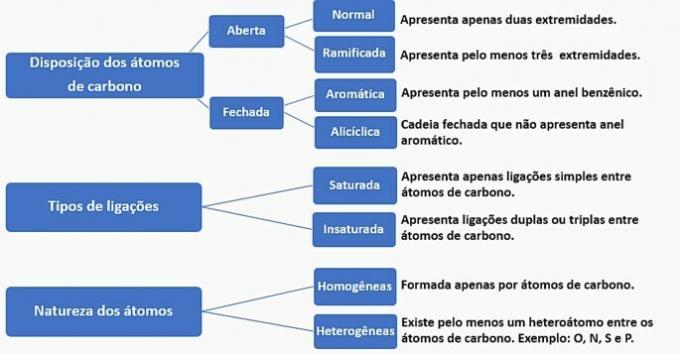
Kulstofkæder kan klassificeres som følger:
Ifølge disse oplysninger har vi:
a) forkert. Kæden er klassificeret som normal, mættet, homogen og alicyklisk.
b) forkert. Kæden er klassificeret som normal, umættet, homogen og åben.
c) forkert. Kæden er klassificeret som forgrenet, umættet, homogen og åben.
d) KORREKT. Kæden er klassificeret som forgrenet, umættet, heterogen og alicyklisk, som
- Den har en gren: methylradikal;
- Har umætning: dobbeltbinding mellem carbonatomer;
- Den har et heteroatom: ilt bundet til to carbonatomer;
- Det præsenterer en lukket kæde: kulhydrater forbundet i en cirkel uden tilstedeværelse af en aromatisk ring.
e) forkert. Kæden er klassificeret som forgrenet, umættet, heterogen og åben.
spørgsmål 3
(Centec-BA) I nedenstående struktur er de nummererede kularter henholdsvis:
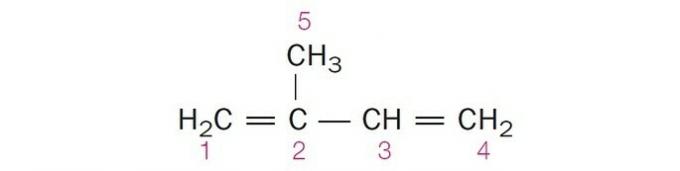
a) sp2, sp, sp2, sp2, sp3.
b) sp, sp3, sp2, sp, sp4.
c) sp2, sp2, sp2, sp2, sp3.
d) sp2, sp, sp, sp2, sp3.
e) sp3, sp, sp2, sp3, sp4.
Korrekt alternativ: c) sp2, sp2, sp2, sp2, sp3.
Fordi det har 4 elektroner i valensskallen, er carbon tetravalent, det vil sige det har en tendens til at danne 4 kovalente bindinger. Disse obligationer kan være enkelt, dobbelt eller tredobbelt.
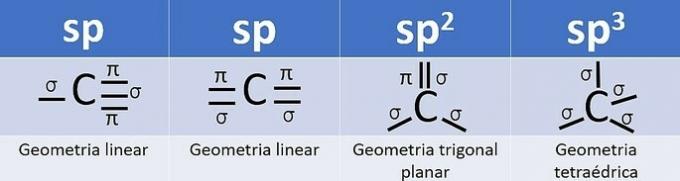
Antallet af hybridorbitaler er summen af sigma-bindingerne (σ) af kulstof, da bindingen hybridiserer ikke.
- sp: 2 sigma-links
- sp2: 3 sigma links
- sp3: 4 sigma-links
Ifølge disse oplysninger har vi:
a) forkert. Carbon 2 har SP-hybridisering2, da den har 3 σ-bindinger og en binding .
b) forkert. Kulstof har ingen SP-hybridisering4 og sp-hybridisering opstår, når der er en tredobbelt binding eller to dobbeltbindinger mellem carbonatomer.
c) KORREKT. Summen af σ-bindingerne på hvert carbon giver den alternative hybridisering.
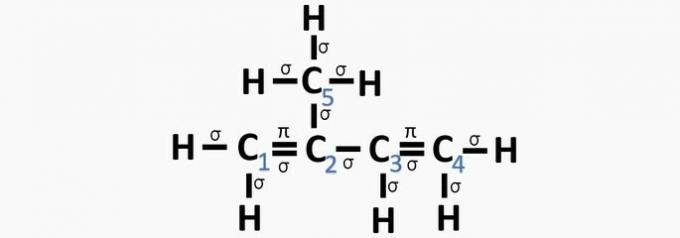
d) forkert. Sp-hybridisering opstår, når der er en tredobbelt binding eller to dobbeltbindinger mellem carbonatomer.
e) forkert. Kulstof har ingen SP-hybridisering4 og sp-hybridisering opstår, når der er en tredobbelt binding eller to dobbeltbindinger mellem carbonatomer.
spørgsmål 4
(UFF) Der er en gasformig prøve dannet af en af følgende forbindelser: CH4; Ç2H4; Ç2H6; Ç3H6 eller C3H8. Hvis 22 g af denne prøve optager et volumen på 24,6 l ved et tryk på 0,5 atm og en temperatur på 27 ° C (givet: R = 0,082 l. Atm. K–1.mol–1) konkluderes det, at det er gassen:
a) etan.
b) metan.
c) propan.
d) propylen.
e) ethen.
Korrekt alternativ: c) propan.
1. trin: konverter temperaturenheden fra Celsius til Kelvin.
2. trin: beregne antallet af mol af forbindelsen ved hjælp af den generelle gasligning.
3. trin: beregne den molære masse af forbindelsen.
4. trin: Find det carbonhydrid, der har en molær masse på 44 g / mol.
Metan
Ethene
Ethan
propylen
Propan
Således konkluderes det, at den gas, der svarer til informationen i erklæringen, er propan.
spørgsmål 5
(ITA) Overvej følgende stoffer:
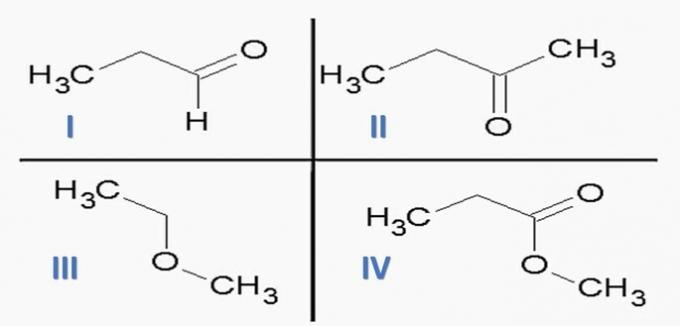
og følgende kemiske funktioner:
Det. carboxylsyre;
B. alkohol;
ç. aldehyd;
d. keton;
og. ester;
f. æter.
Den mulighed, der korrekt forbinder stoffer med kemiske funktioner, er:
a) Id; IIc; IIIe; IVf.
b) Ic; IId; IIIe; Moms
c) Ic; IId; IIIf; IVe.
d) Id; IIc; IIIf; IVe.
e) la; IIc; IIIe; IVd.
Korrekt alternativ: c) Ic; IId; IIIf; IVe.
Organiske funktioner bestemmes af strukturer og grupperer organiske forbindelser med lignende egenskaber.
De kemiske funktioner, der findes i alternativerne, er:
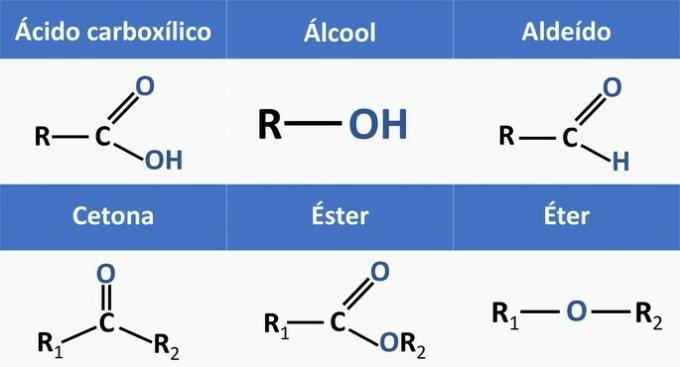
Når vi analyserer ovenstående strukturer og forbindelser, der er til stede i erklæringen, har vi:
a) forkert. Orgelfunktionerne er korrekte, men sekvensen er forkert.
b) forkert. Der er ingen carboxylsyre blandt forbindelserne.
c) KORREKT. Funktionelle grupper til stede i forbindelserne repræsenterer følgende kemiske funktioner.

d) forkert. I er aldehyd og II er keton.
e) forkert. Der er ingen carboxylsyre blandt forbindelserne.
Lær mere på: Organiske funktioner.
Fjendtlige spørgsmål
Spørgsmål 1
(Enem / 2014) En metode til bestemmelse af ethanolindholdet i benzin består i at blande kendte mængder vand og benzin i en bestemt flaske. Efter at have rystet kolben og ventet i et stykke tid, måles volumenen af de to ublandbare faser, der opnås, den ene organiske og den anden vandige. Ethanol, der engang kan blandes med benzin, er nu blandbart med vand.
For at forklare ethanols opførsel før og efter tilsætning af vand er det nødvendigt at vide
a) væskernes tæthed.
b) molekylernes størrelse.
c) kogepunktet for væsker.
d) atomerne til stede i molekylerne.
e) typen af interaktion mellem molekylerne.
Korrekt alternativ: e) typen af interaktion mellem molekylerne.
Intermolekylære kræfter påvirker opløseligheden af organiske forbindelser. Stoffer har tendens til at opløses med hinanden, når de har den samme intermolekylære kraft.
Se i nedenstående tabel nogle eksempler på organiske funktioner og typen af interaktion mellem molekyler.
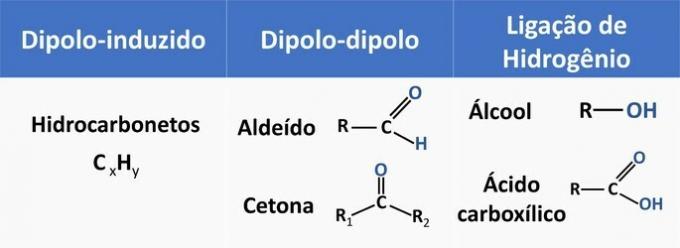
Ethanol betragtes som et polært opløsningsmiddel, da det har en polær gruppe (—OH) i sin struktur. Imidlertid er dens carbonkæde, da den er ikke-polær (CH), i stand til at interagere med ikke-polære opløsningsmidler. Derfor opløses ethanol både i vand og i benzin.
Ifølge disse oplysninger har vi:
a) forkert. Tæthed relaterer massen af et legeme til det besatte volumen.
b) forkert. Molekylernes størrelse påvirker forbindelsernes polaritet: jo større carbonkæden er, desto mere upolært bliver stoffet.
c) forkert. Kogepunktet er nyttigt til adskillelse af molekyler: destillation adskiller forbindelser med forskellige kogepunkter. Jo lavere kogepunktet er, desto lettere fordampes molekylet.
d) forkert. Et aldehyd har kulstof, brint og ilt i sin struktur. Denne forbindelse udfører dipol-dipol-interaktioner, mens en alkohol med de samme grundstoffer er i stand til at danne hydrogenbindinger.
e) KORREKT. Interaktionen mellem ethanol og vand (hydrogenbinding) er mere intens end med benzin (diplo-induceret).
spørgsmål 2
(Enem / 2013) Molekylerne i nanoputere de ligner menneskelige figurer og blev skabt for at stimulere de unges interesse for at forstå sproget udtrykt i strukturformler, der er meget anvendt i organisk kemi. Et eksempel er NanoKid, repræsenteret i figuren:
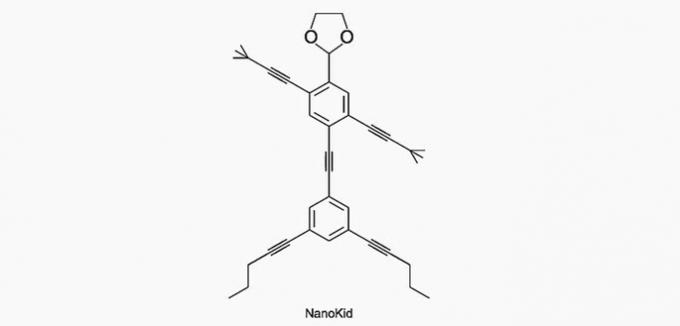
Hvor i NanoKids krop er der kvaternært kulstof?
a) Hænder.
b) Hoved.
c) Bryst.
d) Maven.
e) Fødder.
Korrekt alternativ: a) Hænder.
Kulstof klassificeres som følger:
- Primær: binder til et kulstof;
- Sekundær: binder til to carbonatomer;
- Tertiær: binder til tre carbonatomer;
- Kvartær: binder til fire carbonatomer.
Se eksemplerne nedenfor.

Ifølge disse oplysninger har vi:
a) KORREKT. Kulstoffet i hånden er bundet til fire andre kulstoffer, så det er kvaternært.
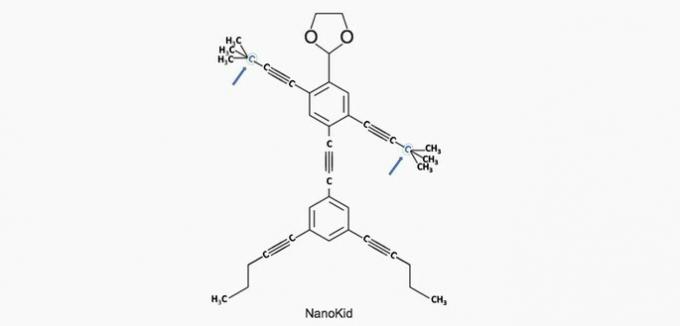
b) forkert. Hovedet består af primære kulhydrater.
c) forkert. Brystet består af sekundære og tertiære carbonatomer.
d) forkert. Maven består af sekundære kulhydrater.
e) forkert. Fødderne er lavet af primære kulhydrater.
spørgsmål 3
(Enem / 2014) Nogle polymere materialer kan ikke bruges til produktion af bestemte typer artefakter, hverken til begrænsninger af mekaniske egenskaber, enten ved, hvor let de nedbrydes, hvilket genererer uønskede biprodukter til det Ansøgning. Derfor bliver inspektion vigtig for at bestemme arten af den polymer, der anvendes til fremstilling af artefakten. En af de mulige metoder er baseret på nedbrydningen af polymeren for at generere de monomerer, der gav anledning til den.
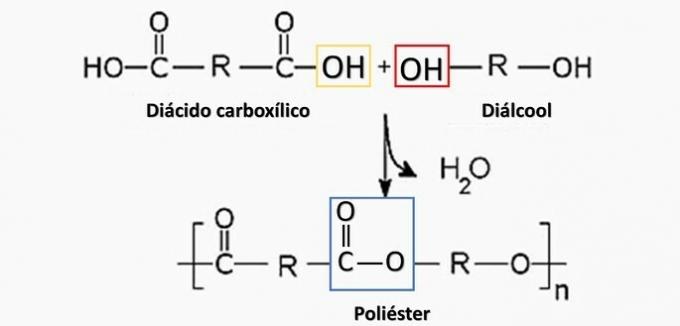
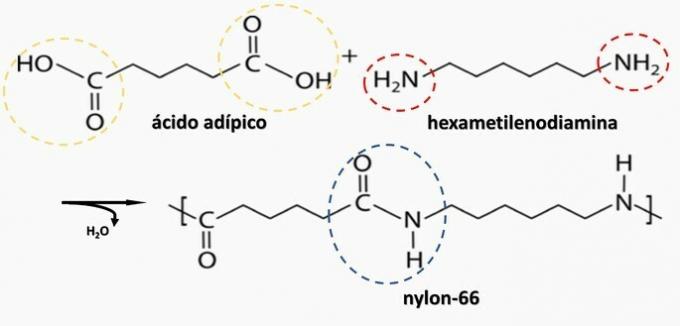
Kontrolleret nedbrydning af en artefaktgenereret diamin H.2N (CH2)6NH2 og HO-syren2C (CH2)4CO2H. Derfor blev artefakten lavet af
a) polyester.
b) polyamid.
c) polyethylen.
d) polyacrylat.
e) polypropylen.
Korrekt alternativ: b) polyamid.
a) forkert. Polyester dannes i reaktionen mellem en dicarboxylsyre (—COOH) og en dialkohol (—OH).
b) KORREKT. Polyamid dannes ved polymerisering af en dicarboxylsyre (—COOH) med en diamin (—NH2).
c) forkert. Polyethylen dannes ved polymerisationen af ethylenmonomer.
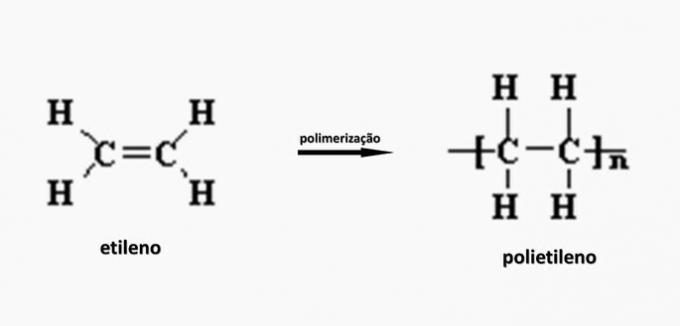
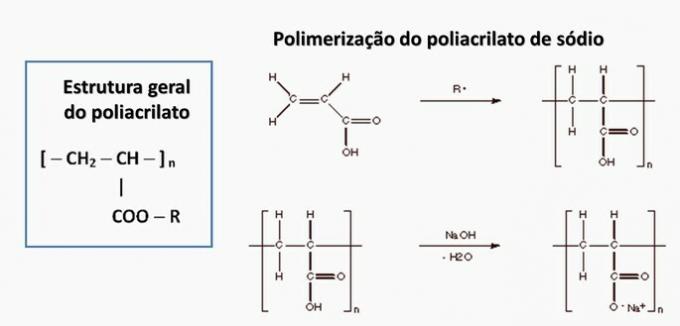
d) forkert. Polyacrylat dannes af et salt afledt af carboxylsyre.
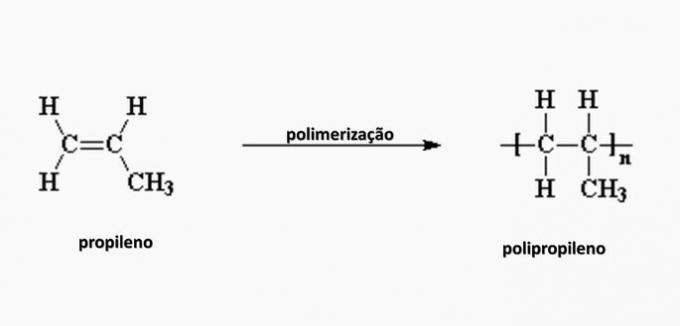
e) forkert. Polypropylen dannes ved polymerisation af propylenmonomer.
spørgsmål 4
(Enem / 2008) Kina har forpligtet sig til at skadesløse Rusland for spild af benzen fra en industri Kinesiske petrokemiske stoffer i Songhua-floden, en biflod til Amur-floden, som udgør en del af grænsen mellem de to lande. Præsidenten for det føderale vandressourceagentur i Rusland forsikrede, at benzen ikke når rørledningerne til drikkevand, men bad befolkningen koge rindende vand og undgå fiskeri i Amur-floden og dens bifloder. Lokale myndigheder opbevarer hundredvis af tons kul, da mineralet betragtes som en effektiv benzenabsorber. Internet: (med tilpasninger). Under hensyntagen til de trufne foranstaltninger for at minimere miljø- og befolkningsskader er det korrekt at anføre det
a) kul, når det placeres i vand, reagerer med benzen og eliminerer det.
b) benzen er mere flygtigt end vand, og det skal derfor koges.
c) orienteringen for at undgå fiskeri skyldes behovet for at bevare fisk.
d) benzen vil ikke forurene drikkevandsledninger, da det naturligt dekanteres i bunden af floden.
e) forureningen forårsaget af den kinesiske industris benzenudslip ville være begrænset til Songhua-floden.
Korrekt alternativ: b) benzen er mere flygtig end vand, og det er derfor nødvendigt, at den koges.
a) forkert. Kul indeholder i sin struktur flere porer og bruges som et adsorberende middel, da det er i stand til at interagere med forurenende stoffer og holde dem på overfladen, men ikke fjerne dem.
b) KORREKT. Jo større et stofs flygtighed er, desto lettere skifter det til en gasformig tilstand. Mens vandets kogepunkt er 100 ° C, er det for benzen 80,1 ° C. Dette skyldes, at vand er en polær forbindelse, og benzen er en ikke-polær forbindelse.
Interaktionen mellem molekyler er forskellig og påvirker også stoffernes kogepunkt. Vandmolekylet er i stand til at danne hydrogenbindinger, en type interaktion, der er meget stærkere end den, som benzen med den inducerede dipol er i stand til at skabe.
c) forkert. I en fødekæde bliver det ene væsen en andens mad i henhold til interaktionerne mellem arter på et sted. Når et giftigt stof frigives i et miljø, er der progressiv ophobning og fisk forurenet, når det indtages af mennesker, kan tage benzen med sig og forårsage DNA-mutationer og endda endda kræft.
d) forkert. Benzen har en lavere densitet end vand. Således er tendensen, at selv under vand fortsætter den med at sprede sig.
e) forkert. Sæsonændringer kan yderligere øge problemet, da lave temperaturer nedsætter kemikaliernes biologiske nedbrydningskapacitet ved solens eller bakteriens virkning.
spørgsmål 5
(Enem / 2019) Kulbrinter er organiske molekyler med en række industrielle anvendelser. For eksempel er de til stede i store mængder i de forskellige petroleumfraktioner og adskilles sædvanligvis ved fraktioneret destillation baseret på deres kogetemperatur. Tabellen viser hovedfraktionerne opnået ved destillation af olie i forskellige temperaturområder.
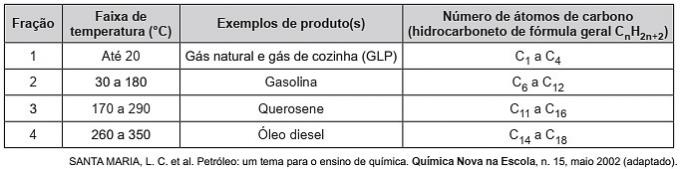
I fraktion 4 sker adskillelsen af forbindelser ved højere temperaturer, fordi
a) deres tætheder er større.
b) antallet af grene er større.
c) dets opløselighed i olie er større.
d) intermolekylære kræfter er mere intense.
e) kulstofkæden er sværere at bryde.
Korrekt alternativ: d) de intermolekylære kræfter er mere intense.
Kulbrinter interagerer med induceret dipol, og denne type intermolekylær kraft intensiveres med stigningen i carbonkæden.
Derfor har de tungere oliefraktioner en højere kogetemperatur, da kæderne interagerer stærkere af en induceret dipol.
For flere øvelser med kommenteret opløsning, se også:
- Øvelser på kulbrinter
- Øvelser på organiske funktioner
- Kemispørgsmål i fjende