Der er flere måder at repræsentere den samme kemiske forbindelse på. Dette sker via den kemiske formel, som kan give os nogle oplysninger om det stof, den repræsenterer.
Vi kender nu 5 former for præsentation af en forbindelse med det organiske stof som et eksempel Benzen.
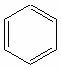
flad strukturformel: Det er formlen, der beskriver alle de elementer, der er til stede i forbindelsesmolekylet og atomernes placering igennem af en flad repræsentation er de par af elektroner, der etablerer den kemiske binding, repræsenteret af bindestreger. (─). Ovenstående strukturformel viser, hvordan atomerne, der udgør benzen, hænger sammen.

molekylær formel: I denne formelform er elementet repræsenteret af dets symbol efterfulgt af indekset (abonnementsnummer), der angiver antallet af atomer til stede i hvert molekyle. Så vi har antallet af atomer, der udgør stoffet, som vi ser, er der 6 carbonatomer (C) og 6 hydrogener (H) i et benzenmolekyle.

empirisk formel: det er som en “opsummeret” måde at repræsentere forbindelserne på. Den enkle struktur giver os kun mulighed for at forstå formen på benzenstrukturen og tilstedeværelsen af umættede (dobbeltbindinger).

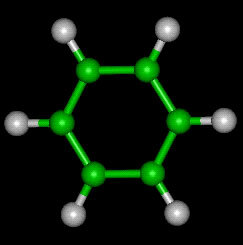
Ball Structure Formula: på denne måde identificeres kulstof og hydrogen ved farve og størrelse, hvor C er repræsenteret af den sorte farve og H med den hvide farve.


Formel i slagtilfælde og boldstruktur
Denne sidste repræsentation er den mest anvendte til at indsætte det organiske kemifag, det tillader det observer strukturens form og visualiser stadig typen af binding, der forbinder hydrogenerne med kæden vigtigste.
Faktisk er der dele på markedet til samling af linjer og kugler, som om det var et puslespil, hvor læreren trin for trin kan demonstrere dannelsen af organiske forbindelser.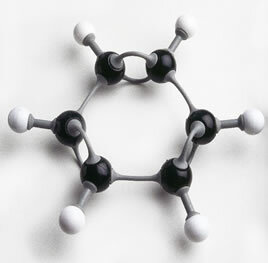
Foto af benzenring samlet med plastdele: et fremragende undervisningsmateriale, der skal arbejdes med i klasseværelset.
Af Líria Alves
Uddannet i kemi
Brazil School Team
Se mere!
Strukturelle formler af kulstof
kemiske formler
Generel kemi - Kemi - Brasilien skole
Kilde: Brasilien skole - https://brasilescola.uol.com.br/quimica/classificacao-das-formulas.htm