O atomstråle af elementer er en periodisk egenskab, der bestemmer radius for et atom, der varierer afhængigt af elementets position i det periodiske system.
Således kan de stige og falde som Atom nummer (Z) for det element, der svarer til antallet af protoner, der er til stede i atomkernen.
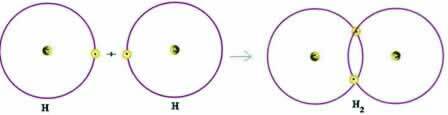
Sammenfattende svarer atomradius til halv afstanden mellem kernerne i to nærliggende atomer, udtrykt som følger:
r = d / 2
hvorfra:
r = radius
d = internuklear afstand
Generelt måles atomradius i picometre (pm), submultipel af måleren (1 picometer = 10-12 m.). Bemærk, at når referencen ikke er et atom, men en ion, er den fundne radius den ioniske radius.
Atomic Radius Variation
I det periodiske system kan væksten af atomradius ses i følgende figur:
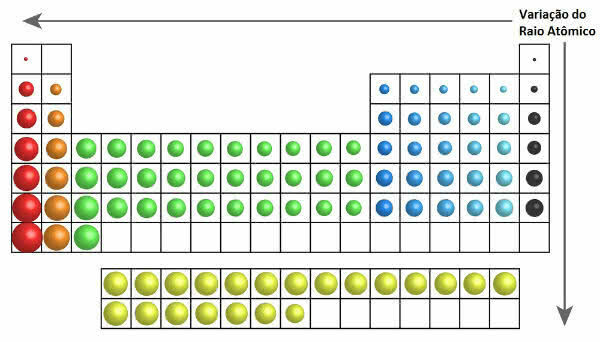 Atomic Radius Variation i det periodiske system
Atomic Radius Variation i det periodiske system
Således stiger atomradius lodret (familier eller grupper) fra top til bund. På vandret (perioder) øges de fra højre til venstre.
Se den omvendte variation i Elektronisk affinitet og elektronegativitet.
Ioniseringsenergi
DET ioniseringsenergi (eller potentiale) det er også en periodisk egenskab, der bestemmer den krævede energi til at skifte en elektron, som udtrykkes i elektronvolt (eV).
Læs også: Periodiske egenskaber.
Tjek spørgsmål til optagelseseksamen med en kommenteret opløsning i: Øvelser på det periodiske system.