DET Kemisk kinetik er et felt, der studerer de faktorer, der påvirker udviklingshastigheden for kemiske reaktioner, det vil sige den hastighed, hvormed de finder sted. Der er mere og mere forskning omkring dette område, da vi ofte vil fremskynde nogle reaktioner eller bremse andre. Dette er især vigtigt for industrier, og denne forskning har vigtige teknologiske konsekvenser.
Men da reaktionshastigheden kan variere for hvert tidsinterval og fra et stof til et andet, er det sædvanligt at beregne gennemsnitlig reaktionshastighed.
Overvej følgende generiske reaktion, hvor koefficienterne er små bogstaver, og reaktanterne og produkterne er repræsenteret med store bogstaver:
a A + b B → c C + d D
Den gennemsnitlige hastighed for denne reaktion vil blive givet dividere den gennemsnitlige reaktionshastighed for et hvilket som helst af de reagerende stoffer eller den gennemsnitlige dannelseshastighed for et af produkterne med dets respektive koefficient i den kemiske ligning. Dette er givet af:
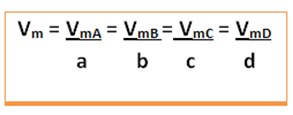
Overvej f.eks. Hydrogenperoxid-nedbrydningsreaktionen:
2 timer2O2 (aq) → 2 H2O(1) + 1 O2 (g)
Lad os sige, at der på 1 minut blev dannet 0,3 mol / l H2O og 0,15 mol / L O2, mens 0,3 mol / L H nedbrydes2O2, det vil sige, de gennemsnitlige nedbrydningshastigheder og dannelse af disse stoffer i reaktionen er:
VmH2O2 = 0,3 mol / l. min
VmH2O = 0,3 mol / l. min
VmO2 = 0,15 mol / l. min
Den gennemsnitlige hastighed for den globale reaktion findes ved at tage en af disse værdier og dividere den med den respektive koefficient i ligningen:
Vm = VmH2O2 = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmH2O = 0,3 mol / l. min = 0,15 mol / l. min
2 2
Vm = VmO2 = 0,15 mol / l. min = 0,15 mol / l. min
1 1
Bemærk, at de tre værdier er ens, derfor er reaktionshastigheden den samme som en funktion af en hvilken som helst reaktant eller et produkt i det samme tidsinterval.
Men hvordan blev værdierne for de gennemsnitlige hastigheder for hvert af de stoffer, der var involveret i disse reaktioner, fundet?
Det kan beregnes dividere variationen i koncentrationen af stoffet (reagens eller produkt) efter tidsintervallet. Hvis vi skal bestemme gennemsnitshastigheden for en af reagenser af reaktionen bliver vi nødt til at sætte en negativt tegn før, ellers overvej koncentrationsværdien i modul ||, da koncentrationen af reaktanten falder over tid, ville hastighedsværdien være negativ, men der er ingen negativ hastighed.
Stop ikke nu... Der er mere efter reklamen;)

Overvej for eksempel følgende ozongasnedbrydningsreaktion (O3 (g)) i iltgas (O2 (g)):
2 O3 (g) → 3 O2 (g)
Lad os sige, at der i en ballon var 10 mol ozongas, men efter 1 minut var der kun 4 mol tilbage; det betyder, at 6 mol ozon forvandles til iltgas. Så vi har:
2 O3 (g) → 3 O2 (g)
t = 0 min 2 mol / L 0 mol / L
udgifter dannet
6 mol / L 9 mol / L
t = 1 min. 4 mol / L 9 mol / L
Bemærk, at da reaktionsforholdet er 2: 3, så hvis der blev anvendt 6 mol O39 mol O blev dannet2. Så efter 1 minut har vi følgende gennemsnitlige hastigheder:
Vm = - ∆ [The3]
t
Vm = - ([O3final - O3 initial])
tEndelig - tinitial
Vm = - ([4 - 10])
1– 0
Vm = 6 mol / l. min→ I 1 minut reagerede 6 mol ozon i hver liter i systemet.
Vm = ∆ [The2]
t
Vm = ([O2final - O2 initial])
tEndelig - tinitial
Vm = ([9 - 0])
1– 0
Vm = 9 mol / l. min→ I løbet af 1 minut blev der dannet 9 mol ilt i hver liter i systemet.
Dette viser os, at vi kan beregne den gennemsnitlige hastighed som en funktion af reaktanterne eller som en funktion af produkterne.
Hvis vi nu vil beregne gennemsnitshastigheden for denne globale reaktion, skal du bare gøre som vi viste i begyndelsen: divider hver af disse hastigheder med deres respektive koefficienter i den kemiske ligning:
Vm = VmO3 = 6 mol / l. min = 3 mol / l. min
2 21
Vm = VmO2 = 9 mol / l. min = 3 mol / l. min
3 3
Vm = VmO3 = VmO2
23
Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Kemiske reaktionshastighed"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm. Adgang til 27. juni 2021.