Chlorider er de ioniske forbindelser, der indeholder anionen Cℓ-1.
Klor er af familien 17 eller 7A, dets atomnummer er lig med 17, og det har 7 elektroner i valensskallen (atomets yderste elektronskal). Ifølge Herske af oktetten, for at være stabil, skal den have 8 elektroner i denne sidste skal, og den skal derfor modtage endnu en elektron. Når dette sker, det vil sige når det generelt modtager en elektron fra en ionbinding med et metal, dannes â.nionchlorid (Cℓ-1), bliver metallet, der opgav elektronen, en kation, og det dannede stof er ionisk.
Chlorider er salte afledt af omsætningen af en base med saltsyre (HC2)(her)). Basen tilvejebringer kationen, og saltsyre tilvejebringer chloridionen:
Generisk base + saltsyre → Chlorid + vand
ÇOH + HCℓ → ÇCℓ + H2O
Klorider er alle klassificeret som uorganiske salte, fordi de i et vandigt medium frigiver en anden kation end H+ og frigør chloridanionen, ikke hydroxyl (OH-).
Nomenklaturen for klorider følger altid denne regel: Chlorid +de + (navnet på det element, der er knyttet til klor).
På dine formler er dannet udveksling af ionafgifter for indekserne (nummer, der er nederst til højre på element-symbolet, hvilket angiver antallet af atomer for det element, der er til stede, og som danner obligationer).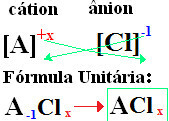
hvis indekset er "1", du behøver ikke at skrive det i formlen, som vist nedenfor:
På+1 Cℓ-1 → På1Cℓ1 → PåC2: natriumchlorid;
K+1 Cℓ-1 → KC2: kaliumchlorid;
Her+2 Cℓ-1→CaC32: Kalcium Klorid;
Ba+2 Cℓ-1→ Bher2: bariumchlorid;
Aℓ+3 Cℓ-1→ACℓ3: aluminiumchlorid.
Som forklaret i teksten “Ioniske stoffer i gruppen: chlorid, carbonat, nitrat og sulfat”, Som med alle ioniske stoffer, har klorider ikke deres enhedsformler isoleret i naturen, da deres ioner tiltrækker hinanden gensidigt og danner krystalgitter.
Det vigtigste eksempel på klorid, vi har i vores daglige liv, er natriumchlorid, NaC3, bordsaltet. Se den ioniske binding, der resulterer i dens dannelse (hvor natrium donerer en elektron til klor) og under krystalgitteret i dette salt:
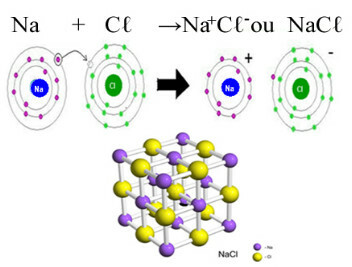
I det krystallinske gitter af natriumchlorid hver anion Cℓ- er omgivet af 6 kationer Na+ og omvendt, så koordinationsnummeret for dette krystalgitter er 6.
Alle klorider er faste stoffer i omgivende forhold og ganske vandopløseligt, er blandt de mest almindelige salte, der findes i vores daglige liv, i betragtning af at flere af dem er opløst i mineralvand, drikkevand, ledningsvand, floder, have, blandt andre. Blandt undtagelserne, der er vanduopløselige chlorider, er sølvchlorid (AgCℓ - vist i nedenstående figur) fra bly, kobber og kviksølvforbindelser.

Vanduopløselig sølvklorid *
Cℓ-ionerne-1 fra de klorider, vi indtager, hovedsagelig i salt, fisk og kød, er vigtige for nogle funktioner i menneskekroppen, da de er den vigtigste ekstracellulære anion, der er til stede i saften gastrisk, regulerer kropsvæsker, såsom vandfordeling i kroppen, og opretholder plasma osmotisk tryk og neutralitet elektrisk.
Dens mangel kan forårsage angst, diarré og kredsløbsproblemer. Dens overskud udskilles gennem urinen (i gennemsnit udskiller hver person ca. 4 g klorid om dagen), sved og afføring.
*Billedkredit: Forfatter: Danny S. / Billede ekstraheret fra: Wikimedia Commons
Af Jennifer Fogaça
Uddannet i kemi