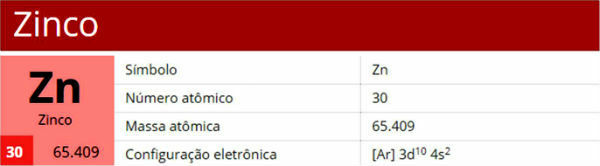
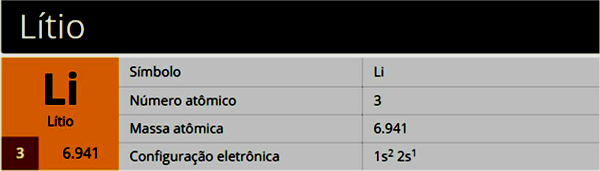
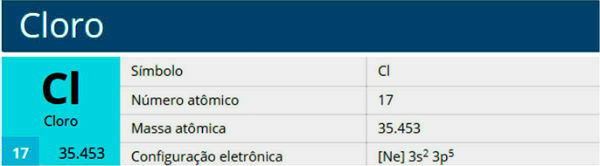
Et atoms struktur er kompleks og fuld af detaljer. I mange år har flere forskere rundt om i verden dedikeret en del af deres liv til at studere et atoms konstitution og skabe modeller og teorier. Takket være dette har vi i øjeblikket viden om flere detaljer i atomforfatningen:
En kerne med protoner og neutroner - foreslået af henholdsvis Rutherford og Chadwick;
Energiniveauer eller elektroniske lag - foreslået af Bohr;
Underniveauer for energi (underregioner på energiniveau) - foreslået af Sommerfeld;
Atomiske orbitaler (sandsynligvis sted at finde en elektron) - foreslået af Erwin Schrödinger.
Regioner omkring kernen (niveauer, underniveauer og orbitaler) har stor relevans, fordi det gennem viden om disse områder var muligt at vide fænomenet fluorescens, phosphorescens, den måde, en kemisk binding opstår på, og en vis fysisk opførsel af stof (magnetisme).
Se hvordan atomens regioner er organiseret:
█ niveauer
Atomet har i alt syv niveauer, repræsenteret af bogstaverne K, L, M, N, O, P, Q, hver med en bestemt mængde energi.
█ underniveauer
Hvert niveau har en bestemt mængde underniveauer, der kun er repræsenteret af fire bogstaver: s, p, d, f.
K - 1 underniveau (r)
L - 2 underniveauer (s, p)
M - 3 underniveauer (s, p, d)
N - 4 underniveauer (s, p, d, f)
O- 4 underniveauer (s, p, d, f)
P - 3 underniveauer (s, p, d)
Q - 2 underniveauer (s, p)
█ Orbitaler
Hver underniveau præsenterer en anden mængde orbitaler:
s = 1orbital
p = 3orbitaler
d = 5orbitaler
f =7orbitaler
Observation: I hver orbital kan vi højst finde to elektroner. Således er det maksimale antal elektroner i et underniveau:
s = 2elektroner
p = 6elektroner
d = 10elektroner
f = 14elektroner
Kendskab til alle disse oplysninger, den amerikanske kemiker Linus Carl Pauling udviklet et værktøj til distribuer elektronerne af et atom mere praktisk på papir. Dette vigtige værktøj blev kaldt Linus Pauling-diagram. I dette diagram har vi kun niveauer og underniveauer. Se en oversigt:
Stop ikke nu... Der er mere efter reklamen;)

slagene ind lyserød og orange de opretter en orden af energi, der løber gennem hele diagrammet. Denne ordre starter med det bindestreg, der passerer ind 1s og følger a diagonalt forløb indtil den når 7p. Hver diagonal linje, der følger, angiver underniveauer med mere energi end den forrige linje. Underniveauet længere nede i den samme diagonale linje har altid mere energi end den foregående. Dermed:
2'ere har mere energi at 1s (findes i forskellige diagonale streger);
4p har mere energi end 3d (til stede i samme diagonale slag).
For at udføre distributionen af elektroner gennem Pauling-diagrammet er det nødvendigt at have antallet af elektroner fra et hvilket som helst atom, følg de diagonale linjer og respekter det maksimale antal elektroner i hvert underniveau. Se nogle eksempler:
— Elektronisk distribution fra Z = 20 (20 elektroner)

Elektronisk distribution af et atom med 20 elektroner
— Elektronisk distribution fra Z = 59 (59 elektroner)

Elektronisk distribution af et atom med 59 elektroner
Synes godt om Linus Pauling-diagram, er det muligt at udføre følgende opgaver:
Distribuer alle elektroner i et atom;
Forudsig atomets laveste og højeste energiregioner (elektroner fordeles i atomet for altid at optage områder med lavere energi);
Forudsig antallet af niveauer af et atom fra dets atomnummer (Z);
Forudsig klassificering af ethvert atom ud fra dets atomnummer (Z).
Fastlæg antallet af obligationer, atomet skal gøre for at opnå stabilitet.
¹ Billedkreditter: Shutterstock / catwalker
Af mig Diogo Lopes Dias
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
DAGE, Diogo Lopes. "Linus Pauling Diagram"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/diagrama-linus-pauling.htm. Adgang til 28. juni 2021.
Kemi

Niels Bohr, Bohrs atom, atomfysik, stabilt atom, atommodel, planetariske system, lag af elektrosfæren, energiniveauer, elektronskaller, elektronenergi, Rutherford atommodel, ophidset tilstandsatom.
Kemi

Atomer og opbygningen af universet, atomteori, at alt er lavet, stof består af atomer, teori om de fire elementer, gamle alkymister, atomteori, grundlæggende partikel.