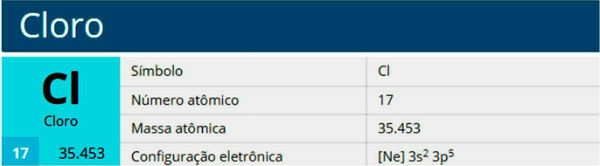
Klor er et kemisk element med symbolet Cl, atomnummer 17, atommasse 35,5. Det tilhører halogenfamilien, gruppe 17 eller 7A og til den tredje periode i det periodiske system.
Dets navn stammer fra græsk khloros, hvilket betyder grønlig. Dette skyldes, at klor under normale forhold med temperatur og tryk er karakteriseret ved at være en grønlig gul gas med en stærk lugt.
Funktioner
Klor blev opdaget i 1774 af den svenske videnskabsmand Carl Wilhelm Scheele (1742-1786). Men på det tidspunkt troede jeg, at det var en forbindelse med ilt. I 1810 demonstrerede Humphry Davy (1778-1829), at det var et nyt kemisk element.
Da det er et ekstremt reaktivt element, findes det næppe i naturen i sin rene form med undtagelse af den lille mængde, der udsendes under vulkanudbrud i form af HCI.
Således findes det almindeligvis i form af natriumchlorid (NaCl), også kendt som bordsalt. I mineraler forekommer det i form af carnallit og sylvite.
Det kan også opnås ved elektrolyse af NaCl i vandig opløsning. Klor producerer også mange salte fra klorider gennem processen med oxidation.
Lær mere, læs også:
- Periodiske system
- Kemiske grundstoffer
- Halogener
applikationer
Klorgas (Cl2) er giftigt og irriterende, førte denne tilstand til, at det blev brugt som et kemisk våben under 1. verdenskrig. Denne gas forårsager irritation i luftvejene og huden, vandretention i lungerne, rive og ved indånding i store mængder kan føre til døden.
Nogle andre anvendelser af klor er:
- Blegning af papir og stoffer ved brug af chlordioxid (ClO2).
- Vandbehandling, tilsætning af klor gør vandet drikkevand og egnet til konsum. Denne proces kaldes klorering og bruger hypochlorsyre (HClO).
- Desinfektion af poolvand og industriaffald, da klor er i stand til at dræbe mikroorganismer.
- Produktion af plastforbindelser såsom PVC (polyvinylchlorid) og syntetisk gummi.
- Produktion af nogle typer organiske og uorganiske forbindelser.