Katalysatorer er stoffer, der er i stand til at fremskynde en reaktion uden at blive ændret, dvs. de forbruges ikke under reaktionen.
For at forstå hvordan katalysatorer fungerer, er vi nødt til at huske, hvad der blev forklaret i teksten "Aktiveringsenergi”. Som vist der, for at en kemisk reaktion kan starte, er det nødvendigt, at reaktanterne har eller modtager en vis mængde minimumsenergi, som kaldes aktiveringsenergi.
Med denne minimale energi er reaktanterne i stand til at nå kompleks aktiveret, som er en mellemtilstand (overgangstilstand), der dannes mellem reaktanter og produkter, hvori struktur eksisterer de svækkede tidligere links og dannelsen af nye links (findes i Produkter).
Overvej for eksempel den generiske reaktion nedenfor:
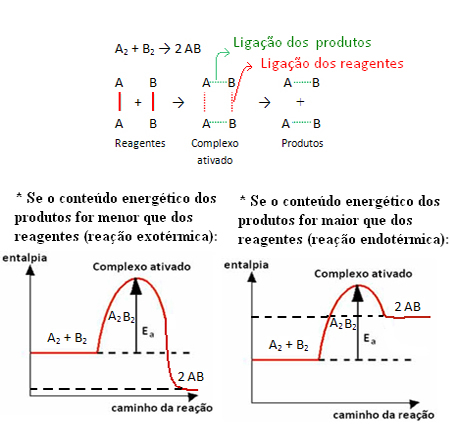
Bemærk, at aktiveringsenergien, der er nødvendig for at nå det aktiverede kompleks, bliver en slags forhindring, der skal overvindes for at reaktionen kan finde sted. Dette betyder, at jo større aktiveringsenergien i en reaktion er, desto større hindring skal overvindes, og jo langsommere er reaktionshastigheden.
Det modsatte gælder også, hvis aktiveringsenergien er lavere, vil reaktionen være hurtigere. Det er præcis hvad katalysatorerne gør de de skaber en alternativ sti, der kræver mindre aktiveringsenergi, hvilket får reaktionen hurtigere.
Stop ikke nu... Der er mere efter reklamen;)

For at sænke aktiveringsenergien virker katalysatoren ved at ændre reaktionsmekanismen ved at kombinere med reagenserne i et system, der kan være monofasisk (homogen katalyse) eller polyfasisk (heterogen katalyse).
Flere detaljer om disse typer katalyse kan ses i nedenstående tekster:
- homogen katalyse
- heterogen katalyse
Men generelt kan vi sige, at dette Kombinationen af reaktanten og katalysatoren danner en mellemforbindelse, som derefter transformeres, hvilket giver anledning til produktet og katalysatoren. Bemærk hvordan dette kan repræsenteres:
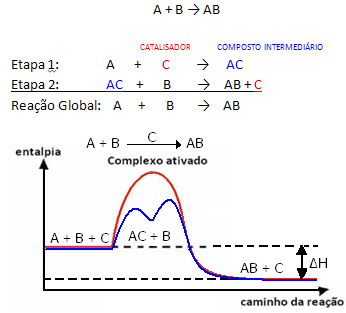
Se, at katalysatoren regenereres ved afslutningen af reaktionen og ikke forbruges af den.
En vigtig kendsgerning er, at katalysatoren fremskynder både den forreste og den omvendte reaktion, det betyder, at det mindsker aktiveringsenergien for begge.
Af Jennifer Fogaça
Uddannet i kemi
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
FOGAÇA, Jennifer Rocha Vargas. "Hvordan virker katalysatorstoffer?"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/como-atuam-as-substancias-catalisadoras.htm. Adgang til 27. juni 2021.


