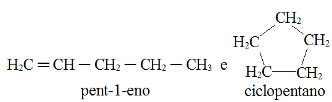Til klassificer et sigma-link, det er vigtigt at vide, hvordan man genkender det i strukturen af et molekyle. Sigma-bindingen er faktisk en kovalent binding opstår, når to ufuldstændige atomorbitaler (med kun en elektron) trænge ind på samme akse. Et eksempel er, når en p-type (helix) orbital interpenetrerer med en anden p-orbital.

p-orbitaler, der interperererer i en p-sigma-binding
I praksis (i øvelser), genkendelsen og klassificeringen af et sigma-link er lavet ud fra strukturformlen af et stof som i nedenstående strukturelle repræsentation:

Strukturel formel af hydrocyansyre
Før du klassificerer et sigma-link, det er nødvendigt at vide, hvordan man genkender det i en strukturformel. Husk bare på dette måder som en kovalent binding er repræsenteret: opkaldet enkel er repræsenteret af et enkelt bindestreg (-), par er repræsenteret af to (=) og linket tredobbelt er repræsenteret af tre (≡). Sigma-bindingen er til stede i en hvilken som helst af de tre repræsentationer af kovalente bindinger som følger:
Enkel: har en sigma-binding;
Par: Af de to links er kun en sigma;
Triple: En af de tre links er sigma.
At vide, hvordan man genkender et sigma-link, er det næste trin at lære at rangere det. Til dette skal vi vide, hvad der er den ufuldstændige orbitale for hvert atom, der er involveret i bindingen:
H - præsenterer den ufuldstændige s orbital, således at den i klassificeringen er repræsenteret af s.
Ametaler- har en ufuldstændig p-orbital, således at de i klassificeringen er repræsenteret af p med undtagelse af følgende elementer:
Kulstof: Din ufuldstændige orbital afhænger af typen af hybridisering at han lider. Mulighederne er: sp hybridisering3 (hvor meget laver det fire enkle opkald), sp2 (hvor meget laver det to enkelt- og en dobbeltbinding) eller sp (hvor meget det udfører to dobbeltbindinger eller en enkelt og en tredobbelt). Således kan kulstof i klassificeringen af en sigma-binding repræsenteres af sp3, sp2 eller sp afhængigt af det opkald, du foretager.
Beryllium:lide sp-type hybridiseringsåledes repræsenteret i klassificeringen ved sp.
Bor:lide sp-type hybridisering2, således, i klassificeringen er det repræsenteret af sp.2.
Med al denne information er den nemmeste del at klassificere sigma-linkene, der findes i en struktur. Lad os se nogle eksempler:
Eksempel 1: sigmaforbindelser i vand

Strukturel formel for vand
Stop ikke nu... Der er mere efter reklamen;)
Ovenstående strukturformel viser, at vand har to sigma obligationer (to enkle), er de mellem iltet (repræsenteret af s) Det er Brint (repræsenteret af s). Således har vi to sigma-links klassificeret i:
s-p
Eksempel 2: Sigma binder i phosphortrichlorid

Strukturformel af phosphortrichlorid
Ovenstående strukturformel viser, at phosphortrichlorid har tre opkaldsigmas (tre enkle), er de gå ind i fosforet (repræsenteret af s) Det er klor (repræsenteret af s). Således har vi tre sigma-links klassificeret i:
p-p
Eksempel 3: sigma-bindinger i bortrifluorid
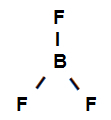
Strukturformel for bortrifluorid
Ovenstående strukturformel viser, at bortrifluorid har tre sigma-links (tre enkle), er de gå ind i boret (repræsenteret af sp2) Det er Fluor (repræsenteret af s). Således har vi tre sigma-links klassificeret i:
p-sp2
Eksempel 4: sigma-bindinger i ethanol
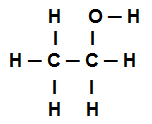
Ethanol strukturformel
Ovenstående strukturformel for ethanol viser det vi har otte opkald sigmas (otte enkle links). Er de:
Én blandt iltet (repræsenteret af p) og hydrogenet (repræsenteret af s). Således klassificeres linket i sigma s-p.
Et af to kulstoffer der kun udfører sigmaforbindelser (og derefter repræsenteret af sp3). Således er linket klassificeret i sp3-P3.
En blandt kulstofferne (repræsenteret af sp3) og iltet (repræsenteret af s). Således klassificeres sigma-linket i p-sp3.
fem mellem kulstof (repræsenteret af sp3) og hydrogenet (repræsenteret af s). Således klassificeres alle fem i s-sp3.
Eksempel 5: Sigma-bindinger i dichlorethen

Dichlorethen strukturel formel
Ovenstående strukturformel for dichlorethen viser, at vi har tilstedeværelsen af fem sigma-links (de fire enkeltbindinger og en af dobbeltbindingerne). Er de:
Et af to kulstoffer der danner to enkelt- og en dobbeltbinding (og derefter repræsenteret af sp2). Således klassificeres sigma-linket i sp2-P2.
Fire er mellem kulstof(repræsenteret af sp2)og hydrogenet (repræsenteret af s). Således klassificeres alle fire i s-sp2.
Af mig Diogo Lopes Dias
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
DAGE, Diogo Lopes. "Klassificering af et sigma-link"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/classificacao-uma-ligacao-sigma.htm. Adgang til 28. juni 2021.