Batteri er en enhed, hvor en elektrisk strøm produceres af kemisk energi, der kommer fra en oxidoreduktion reaktion, det vil sige, at en art af reaktanten mister elektroner (oxidation), mens en anden art vinder elektroner (reduktion).
Se repræsentationer af oxidations- og reduktionsreaktioner, der forekommer i enhver stak:
Oxidation: X → og + X+
Arter X mister en elektron og bliver til en kation.
Reduktion: Y- + og → Y
Y-anionen- vinder elektron og omdannes til en neutral Y-art.
Grundlæggende komponenter i en stak
De grundlæggende komponenter i en stak er:
Anode: negativ elektrode, hvor oxidationsreaktionen finder sted, dvs. tab af elektroner;
Katode: positiv elektrode, hvor reduktionsreaktionen finder sted, dvs. elektronforstærkning;
Elektrolytisk opløsning (saltbro) eller et ledende materiale (såsom en grafitstang): er det middel, hvormed elektroner, der er opgivet af anoden, når katoden.
Grundlæggende om, hvordan et batteri fungerer
Funktionen af en stak sker fra følgende begivenheder:
1. princip: Anode oxidation
Metallet i anoden, da det har en større tendens til at miste elektroner, bliver et kation, som vi observerede i nedenstående ligning:
Zn → Zn2+ + 2 og
2. princip: katode reduktion
Kationerne, der er en del af det materiale, der er til stede i katoden (vi bruger kobber som et eksempel), når de modtages elektronerne fra anoden omdannes til metallisk kobber, som vi kan se i ligningen bælge:
Røv2+ + 2e → Cu
første bunker
a) Alessandro Voltas batteri
Alessandros bunke (den første bunke i historien), samlet i 1800, blev dannet af indskalede metalskiver, som på billedet nedenfor:

Montering svarende til Alessandros ryg til din bunke
Diskene blev sammenflettet, fordi de havde en anden sammensætning. Den ene var lavet af zinkmetal, og den anden var lavet af kobber, der altid blev adskilt af bomuld gennemblødt i saltopløsning (en opløsning dannet af vand og salt).
B) Daniels bunke
Daniels bunke, samlet i 1836, bestod af to halvceller forbundet med en ledende ledning og en saltbro.
Halvcelle 1: det var anoden, det vil sige batteriets negative pol.
Den var sammensat af en zinkplade, og en del af denne plade blev nedsænket i en opløsning dannet af vand og zinksulfat (ZnSO4).
Halvcelle 2: det var katoden, det vil sige batteriets positive pol.
Den bestod af en kobberplade, og en del af denne plade blev nedsænket i en opløsning dannet af vand og kobbersulfat (CuSO4).
saltbro
U-formet rør, der indeholdt en opløsning dannet af vand og kaliumchlorid (KCl), som forbandt de to halvceller (zink og kobber) og havde en glasuld i begge ender.
batterier i øjeblikket
I øjeblikket er der flere modeller af stakke, men generelt ser de sådan ud:
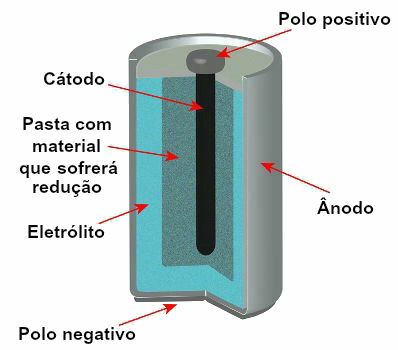
Skematisk repræsentation af modellen for en nuværende stak
De mest anvendte modeller er det såkaldte Leclanché-batteri og det alkaliske batteri, som har følgende forskelle:
Det) Leclanche bunke
Den har en anode dannet af metallisk zink;
Den har en katode dannet af en pasta med ammoniumchlorid, vand, stivelse og mangandioxid;
Den har en grafitstang, der fungerer som en leder for elektronerne, der afgår fra katoden mod anoden.
B) Alkalisk batteri
Den har en anode dannet af metallisk zink eller cadmium;
Den har en katode dannet af kviksølvoxid, nikkeloxid og jod;
Det skal have en blandet base i det materiale, der udgør katoden.
Af mig Diogo Lopes Dias
Kilde: Brasilien skole - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm
