Indtil 1824 blev det antaget, at de termiske maskiner, der blev bygget, kunne gennemgå en funktion perfekt, det vil sige, man troede, at de kunne nå 100% udbytte eller noget tæt på det værdi. Med andre ord troede forskere på det tidspunkt, at de kunne bruge al termisk energi leveret til disse maskiner - det vil sige, de troede, at de kunne omdanne al den energi til arbejde.
Ingeniør Sadi Carnot var på det tidspunkt ansvarlig for at foretage demonstrationer, hvor det var umuligt at opnå 100% udbytte. Sadi foreslog, at en ideel teoretisk termisk maskine ville arbejde gennem en bestemt cyklus, nu kaldet Carnot cyklus.
I sin demonstration konceptualiserede Carnot to postulater, som blev foreslået allerede før den første lov om termodynamik blev udtalt. Se hvad Carnot's postulater udtaler:
1. postulat af Carnot
- Ingen maskine, der kører mellem to faste temperaturer, kan give større end Carnots ideelle maskine, der kører mellem de samme temperaturer.
2. postulat af Carnot
- Når maskinen kører mellem to temperaturer ideel af Carnot har samme ydeevne, uanset driftsvæske, og er fuldstændig reversibeluden at tilføje energi.
Ifølge de postulater, der fremgår af Carnot, kan vi se garantien for, at effektiviteten af en termisk motor er en funktion af temperaturerne i de varme og kolde kilder. Men ved at fastsætte temperaturerne i disse kilder er Carnots teoretiske maskine den, der formår at have den højeste effektivitet.
Carnot-cyklussen er en idealiseret, reversibel cyklus, hvor driftsvæsken er en perfekt gas, der svarer til to transformationer. isotermer det er to adiabatisk, afbrudt. Processerne beskrevet af gassen i denne cyklus er:
1.°) isoterm ekspansion DA, hvor gassen er i kontakt med systemet med konstant temperatur TA (varm kilde), der modtager en mængde varme QA fra den.
2.°) adiabatic expansion AB, hvor der ikke er nogen varmeveksling med miljøet. Systemet udfører arbejde med et fald i intern energi og derfor i temperatur.
3.°) BC isoterm sammentrækning, hvor gassen er i kontakt med systemet med konstant temperatur TB (kold kilde), hvilket giver den en mængde varme QB.
4.°) adiabatisk sammentræknings-CD, hvor gassen ikke udveksler varme med miljøet. Systemet modtager arbejde, der tjener til at øge dets interne energi og dermed dets temperatur.
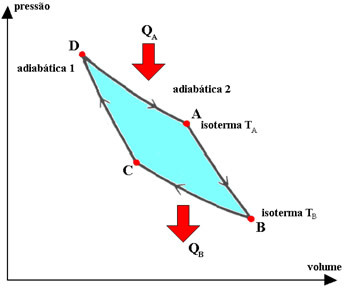
I Carnot-cyklussen, varmevekslet (QDET og QB) og termodynamiske temperaturer (TDET og TB) af de varme og kolde kilder er proportionale, og forholdet er:

Ved at erstatte effektivitetsligningen for en termisk maskine får vi til Carnot-maskinen:
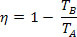
I betragtning af temperaturen på den kolde kilde (TB) lig med nul kelvin (absolut nul), har vi η = 1 eller η = 100%. Imidlertid strider denne kendsgerning mod den anden lov om termodynamik, som garanterer, at en indkomst på 100%, hvilket får os til at konkludere, at intet fysisk system kan have en temperatur lig med nul absolut.
Af Domitiano Marques
Uddannet i fysik
Kilde: Brasilien skole - https://brasilescola.uol.com.br/fisica/maquinas-carnot.htm
