DET molekylær geometri, dvs. arrangementet af atomer i et molekyle, kan bestemmes af kemikerens regel Gillespie, hvor han angiver antallet af atomer knyttet til et centralt atom og antallet af skyer elektronik.
Viden om et molekyls geometri er yderst vigtig, fordi det hjælper os med at bestem polariteten og følgelig opløseligheden (i henhold til reglen for lignende opløsninger lignende).
med opkaldet tetrahedral geometri, er ikke anderledes. Se kriterierne for at bestemme det i henhold til Gillespies regler:
Pentatomiske molekyler (fem atomer);
Fravær af elektroniske skyer i det centrale atom;
sammensatte molekyler eller sammensatte anioner.
Nogle eksempler på molekyler, hvis geometri er tetraedrisk de er:
CH4

CH strukturformel4
Kulstof har fire elektroner i sin valensskal, og alle disse elektroner binder sig til hydrogener. Derfor har kulstof ikke en elektronisk sky (ekstra par elektroner).
KUN4-2
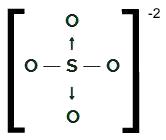
OS strukturformel4-2
Svovl, som har seks elektroner i valensskallen, danner to enkeltbindinger med to iltatomer og to
dative kovalente bindinger med de to andre oxygener. I enkeltbindinger bruger den to af dens elektroner, og i hver dativ bruger den yderligere to (i alt fire elektroner involveret i dativer), i alt seks elektroner. Som sådan har den ingen sky tilbage.NH4+

NH strukturformel4+
Kvælstof, der har fem elektroner i valensskallen, danner tre enkeltbindinger med hydrogenatomer og en dativbinding med det andet brint. I enkeltbindinger bruger den tre af sine elektroner, og i dativen bruger den yderligere to, i alt fem elektroner. Som sådan har den ingen sky tilbage.
CH3Cl
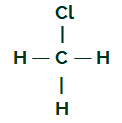
CH strukturformel3Cl
Stop ikke nu... Der er mere efter reklamen;)
Kulstof har fire elektroner i sin valensskal, og alle disse elektroner binder sig til hydrogenerne og kloratomet. Af denne grund har kulstof ikke en elektronisk sky.
→ Molekylpolaritet
Når vi ved, at et givet molekyle har tetrahedral geometri, kan vi bestemme dets polaritet på ekstremt enkel form, da molekylet har sine fire poler optaget (fire ligander i atomet central). Til dette er det nok at kende bindemidlets egenskaber og overveje en af følgende regler:
Hvis antallet af skyer er lig med antallet af lige ligander = ikke-polært molekyle;
Hvis antallet af skyer er forskelligt fra antallet af lige ligander = polært molekyle.
I de følgende to molekyler, hvis geometri er tetraedrisk, kan vi anvende ovenstående regler og angive deres polaritet:
Methan Molecule
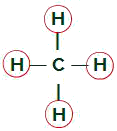
Lige ligander i methanmolekylet
Methanmolekylet har fire elektronskyer (fire enkeltbindinger) og også fire hydrogenatomer fastgjort til det centrale atom. Dermed, vi harfireskyer og fire lige store bindemidlersnart, den molekyle er ikke-polært.
Observation: Hvis stoffets molekyle er undskyld, det opløses godt i et andet stof, hvis molekyler også er ikke-polær.
Chlormethanmolekyle

Lige ligander i chlormethanmolekylet
Chlormethanmolekylet har fire elektronskyer (fire enkeltbindinger) og tre brintatomer og et kloratom bundet til det centrale atom. Dermed, vi harfireskyer og tre lige ligander (tre hydrogener); snart, den molekyle er polært.
Observation: Hvis stoffets molekyle er polar, det opløses godt i et andet stof, hvis molekyler også er polar.
Af mig Diogo Lopes Dias
Vil du henvise til denne tekst i et skole- eller akademisk arbejde? Se:
DAGE, Diogo Lopes. "Tetrahedral geometri"; Brasilien skole. Tilgængelig i: https://brasilescola.uol.com.br/quimica/geometria-tetraedrica.htm. Adgang til 28. juni 2021.