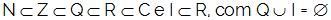Tonoskopie je společné vlastnictví který studuje snižování maximální tlak páry daného rozpouštědla v důsledku rozpuštění netěkavé (molekulární nebo iontové) rozpuštěné látky. Ostatní koligativní vlastnosti jsou:
Ebulioskopie
kryoskopie
osmóza
Z výše uvedené definice je zřejmé, že skutečně rozumíme co je tonoskopie, Je nezbytné znát tři další pojmy:
Je to síla vyvíjená párou určité kapaliny na stěnách uzavřené nádoby, když se rychlost odpařování rovná rychlosti kondenzace.
V nádobě s určitým množstvím ethanolu, který se odpařuje pod vlivem teploty prostředí, protože pára se setkává se stěnami nádoby, končí v kapalný. Časem se rychlost odpařování rovná rychlosti kondenzace. V tomto okamžiku se síla, kterou pára působí na stěny nádoby, nazývá maximální tlak páry.
Mentální mapa: tonometrie nebo tonoskopie

* Chcete-li stáhnout myšlenkovou mapu v PDF, Klikněte zde!
Rozpuštění
Je to schopnost rozpouštědla rozpustit určitou rozpuštěnou látku. Po rozpuštění začne rozpuštěná látka a rozpouštědlo navazovat mezi sebou intermolekulární interakci, to znamená, že jsou vzájemně propojeny.
energeticky nezávislá látka
Je to materiál, který má vysokou teplotu varu, to znamená, že se například nemůže proměnit v plyn při okolních teplotách. Když se tedy přidá do rozpouštědla, nedojde ke ztrátě tohoto materiálu pro životní prostředí ve formě plynu.
Ó netěkavá molekulární látka je ten, který není schopen podstoupit ionizaci nebo disociaci po rozpuštění v rozpouštědle. Pokud tedy do rozpouštědla přidáme molekulu této rozpuštěné látky, bude to jen uprostřed.
Vyiontový netěkavý olut é který trpí fenoménem disociace nebo ionizace, to znamená, že v něm dochází k rozbití vazeb mezi atomy, což způsobí frakcionace molekulární jednotky. Pokud rozpustíme 1 mol kyseliny sírové (H2POUZE4) ve vodě například budeme mít ve středu přítomnost dvou molů hydroniového kationtu a jednoho molu síranového aniontu, jak je znázorněno v níže uvedené rovnici:
H2POUZE4 + 2 hodiny2O → 2H+ + OS4-2
Nepřestávejte... Po reklamě je toho víc;)
Vyjasněním těchto základních pojmů je snazší a jasnější porozumět tonoskopii.
Porozumění tonoskopii
Abychom porozuměli tonoskopii, pojďme stručně studovat chování kapalin, jako je voda a ethanol. Body varu těchto dvou rozpouštědel jsou 100ÓC a 78ÓC. Proto je ethanol odpařován rychleji než voda, pokud má stejnou teplotu a stejné množství.
Pokud je v jedné nádobě 50 ml ethanolu a 50 ml vody v jiné nádobě, například uzavřené a 250ÓC, maximální tlak páry v nádobě na ethanol bude vyšší, protože uvnitř je vyšší množství páry.
graficky řečeno, kdykoli je křivka kapaliny dále od osy y (vertikální), tím nižší bude její maximální tlak par, jako v níže uvedeném grafu:

Tlak páry různých kapalin
Grafické titulky: Propanon = propanon (aceton)
Ethanol = ethanol
voda = voda
Kyselina etanová = Kyselina etanová
V grafu můžeme potvrdit, že tlak par ethanolu (červená křivka) je vždy větší než u vody (modrá křivka) při jakékoli teplotě.
POZNÁMKA: Stručně řečeno, čím vyšší je bod varu daného rozpouštědla, tím nižší je jeho maximální tlak par a naopak.
Jako tonoskopie studuje pokles maximálního tlaku par v důsledku rozpuštění netěkavé rozpuštěné látky v rozpouštědle, pokud smícháme chlorid sodný (NaCl) ve vodě, maximální tlak vodní páry při 100ÓC, což je 760 mmHg, se určitě sníží. Ale proč se to stalo?
Když se chlorid sodný (iontový roztok) rozpouští ve vodě, jeho ionty interagují s molekulami vody. Tato interakce ztěžuje odpařování rozpouštědla. Vzhledem k omezenému odpařování bude v nádobě méně vodní páry, což způsobí snížení maximálního tlaku par.
Tím pádem, čím větší je množství chloridu sodného ve stejném množství vody, tím obtížnější bude odpařování a tím nižší bude maximální tlak par.
Podle mě. Diogo Lopes Dias
Chemie

Disociace a ionizace, italský vědec Volta, elektrický proud, švédský fyzikální chemik Svant August Arrhenius, teorie Arrhenius, kladné ionty, kationty, záporné ionty, anionty, hydroxid sodný, stolní sůl, polární molekuly, disociace iontový,
Chemie

Kolektivní vlastnosti, tonoskopie, ebullioskopie, kryoskopie, osmoskopie, koligativní účinky, snížení chemického potenciálu rozpouštědla, teplota varu, pokles bodu tání, osmotický tlak, netěkavá rozpuštěná látka, rozpuštěná látka, rozpouštědlo, tempe