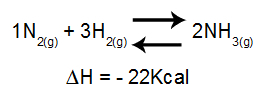THE Hessův zákon navrhl to v roce 1840 švýcarský lékař a chemik Germain Henri Hess. Během své práce na energii ve formě tepla v neutralizační reakce v kyselinas a základnas, došel k závěru, že součet energií v tomto typu reakce byl vždy konstantní.
Studie švýcarského vědce vedly k návrhu následujícího zákona:
“Variace entalpie podílející se na chemické reakci za určitých experimentálních podmínek závisí výhradně na entalpii počáteční a konečné produkty, ať už se reakce provádí přímo v jednom kroku nebo se provádí nepřímo v sérii fází. “
Obecně je výpočet aH reakce nezávislý na počtu kroků a typu reakce a provádí se následujícím výrazem:
?H = Hp-Hr
Když nejsme schopni vypočítat? H konkrétní chemické reakce, můžeme to určit součtem? Hs kroků, které tvoří tuto reakci:
?H =? H1 +? H2 +? H3 + ...
Příkladem je stanovení energie podílející se na transformaci grafitového uhlíku na diamantový uhlík (C(G) → C.d)). K určení? H tohoto procesu máme k dispozici následující kroky:
C(G) + O.2 (g) → CO2 (g) AH = -94 kcal
CO2 (g) → C.d) + O.2 (g) AH = +94,5 kcal
Protože existují sloučeniny, které se opakují (CO2 to je2) v obou rovnicích, ale v různých oblastech (činidla nebo produkty) jsou eliminovány. Stačí tedy přidat? Hs, protože oba O2 kolik CO2 jsou na opačných stranách rovnice:
?H =? H1 +? H2
?H = -94 + 94,5
?H = 0,5 kcal
Základy Hessova zákona
kdy musíme vypočítat změnu entalpie reakce z jeho kroků a jeho změn entalpie musíme mít na paměti, že konečná reakce je, kdo bude diktovat tento výpočet.
Všechny poskytnuté kroky jsou zpracovány tak, aby byly plně v souladu s konečnou reakcí. Například pokud máme konečnou reakci:
Celková reakce: X + Y → Z
Cvičení poskytuje následující kroky:
Krok 1: X + D → W + E
Krok 2: Z + D → F + E
Krok 3: F → Y + W
Je jasné, že kroky 2 a 3 neposlouchají finální reakci, protože v 2 je A v reaktantu a v 3 je Y v produktu. V tomto případě tyto kroky vyžadují „léčbu“, aby vyhověly konečné nebo globální reakci. Pochopte, co je to „léčba“:
Možnosti práce s kroky reakce v Hessově zákoně
a) Obraťte celou rovnici
Rovnici lze převrátit (reaktanty se stávají produkty a produkty se stávají reaktanty), aby odpovídaly pozici účastníků. V tomto případě bude hodnota? H mít své znaménko invertováno.
V níže uvedeném příkladu je zřejmé, že kroky 2 a 3 musí být obráceny:
Celková reakce: X + Y → Z
Krok 1: X + D → W + E
Krok 2: Z + D → F + E
Krok 3: F → Y + W
b) Vynásobte rovnici
Rovnici lze vynásobit libovolnou číselnou hodnotou, aby se vyrovnal počet účastníků. V takovém případě musí být hodnota? H vynásobena.
V níže uvedeném příkladu je zřejmé, že krok 2 musí být vynásoben 2, aby se rovnal počtu účastníků B a C vzhledem k globální rovnici.
Nepřestávejte... Po reklamě je toho víc;)
Celková reakce: A + 2B → 2C
Krok 1: A + 2D → 2Z
Krok 2: Z + B → C + D
c) Rozdělte celou rovnici
Rovnici lze rozdělit libovolnou číselnou hodnotou, aby se vyrovnal počet účastníků. V tomto případě musí být také hodnota H rozdělena.
V níže uvedeném příkladu je zřejmé, že krok 2 musí být vydělen 2, aby se rovnal počtu účastníků F a C ve vztahu ke globální rovnici.
Celková reakce: W + F → 2C
Krok 1: W + 2D → 2Z
Krok 2: 4Z + 2F → 4C + 4D
Příklad aplikace Hessova zákona
Příklad: Kompletní spalovací reakce (tvorba oxidu uhličitého a vody) butanového plynu je dána následující rovnicí:
C4H10 (g) + 13 / 2O2 (g) → 4CO2 (g) + 5 hodin2Ó(G)
S vědomím toho butanu, C.4H10, je plyn přítomný v největším množství ve varném plynu (LPG), určete hodnotu jeho entalpie, s odkazem na následující údaje pro standardní entalpie tvorby každé z nich komponenty:
C(s) + 5 hodin2 (g) → 1C4H10 (g) AH = -125 kcal
C(s) + O.2 (g) → CO2 (g) AH = -394 kcal
H2 (g) + 1 / 2O2 (g) → H2Ó(G) AH = -242 kcal
Řešení:
1Ó Krok: Krok 1 musí být obrácen, protože podle globální rovnice musí být látka reaktivní, nikoli produkt. S tímto je také znaménko hodnoty? H invertováno:
1C4H10 (g) → 4C(s) + 5 hodin2 (g)? H = + 125 kcal
2Ó Krok: Krok 2 musí být dodržen, ale bude muset být vynásoben čtyřmi, protože podle globální rovnice musí mít 4 mol CO2. Hodnota HH tedy musí být vynásobena také 4:
(4x) C(s) + O.2 (g) → CO2 (g) AH = -394 kcal
již brzy:
4C(s) + 4 O.2 (g) → 4 CO2 (g) AH = -1576 kcal
3Ó Krok: Krok 3 musí být dodržen, ale bude muset být vynásoben pěti, protože podle globální rovnice musí mít 5 mol H2Ó. Hodnota HH tedy musí být vynásobena také 5:
(5x) H2 (g) + 1 / 2O2 (g) → H2Ó(G) AH = -242 kcal
již brzy:
5 hodin2 (g) + 5 / 2O2 (g) → 5h2Ó(G AH = -1210 kcal
4Ó Krok: Provádět mazání:
Krok 1: 1C4H10 (g) → 4C(s) + 5 hodin2 (g)? H = + 125 kcal
Krok 2: 4C(s) + 4 O.2 (g) → 4 CO2 (g) AH = -1576 kcal
Krok 3: 5 hodin2 (g) + 5 / 2O2 (g) → 5h2Ó(G AH = -1210 kcal
před 5 hodinami2 v produktu z kroku 1 a v reagenci z kroku 3 jsou proto eliminovány;
V produktu z kroku 1 a činidla z kroku 2 je 4 ° C, takže jsou vyloučeny.
Kroky tedy zůstávají následující:
Krok 1: 1C4H10 (g) → ? H = + 125 kcal
Krok 2: + 4 O.2 (g) → 4 CO2 (g) AH = -1576 kcal
Krok 3: + 5 / 2O2 (g) → 5h2Ó(G AH = -1210 kcal
Přidáním kroků po eliminaci zjistíme, že jsou v souladu s celkovou reakcí.
C4H10 (g) + 13 / 2O2 (g) → 4CO2 (g) + 5 hodin2Ó(G)
5Ó Krok: Přidejte hodnoty ? hod z kroků k určení ? H globální reakce.
?H =? H1 +? H2 +? H3
?H = 125 + (-1576) + (-1210)
?H = 125 - 1576 - 1210
?H = 125 - 2786
?H = - 661 kcal
Podle mě. Diogo Lopes Dias