podvojná sůl je jméno dané jedné z klasifikací, které anorganické soli může přijímat. Ostatní klasifikace jsou: jednoduchá, kamenec, hydroxylovaný, hydrogenovaný a hydratované. Aby mohla být anorganická sůl charakterizována jako podvojná sůl, musí mít jednu z níže popsaných kombinací:
Kation (Y) a jakékoli dva anionty (X a W), a je reprezentován následujícím vzorcem:
YXW
Anion (X) a jakékoli dva kationty (Y a Z), a je reprezentován následujícím vzorcem:
YZX
Poznámka: Tyto soli se tvoří, když a neutralizační reakce se provádí mezi dvěma základny jiný a jeden kyselinanebo mezi dvěma různými kyselinami a zásadou.
Pravidlo pojmenování podvojné soli
Jmenovat a podvojná sůlJe třeba nejprve znát jeho složení, protože pro každý typ podvojné soli existuje zvláštní pravidlo pojmenování, jak je vidět níže:
a) Pravidlo nomenklatury pro podvojnou sůl se dvěma kationty
Když jeden podvojná sůl má dva kationy, musíme použít následující pravidlo:

Pravidlo nomenklatury používané pro dvojné soli se dvěma kationty
Následují dva příklady použití tohoto pravidla pojmenování:
1. příklad: Čára4s
Tato sůl se skládá z:
Anion: sulfid (S.-2);
Elektropozitivnější kation: lithium (Li+1);
Méně elektropozitivní kation: amonium (NH4+1).
Proto se jmenuje lithium (dvojitý) amoniumsulfid.
2. příklad: RbCaBO3
Tato sůl se skládá z:
Anion: boritan (BO3-3);
Elektropozitivnější kation: rubidium (Rb+1);
Méně elektropozitivní kation: vápník (Ca+2).
Jmenuje se tedy borát (dvojitý) rubidia a vápníku.
b) Pravidlo nomenklatury pro podvojnou sůl se dvěma anionty
Když jeden podvojná sůl má dva anionty, musíme použít následující pravidlo:
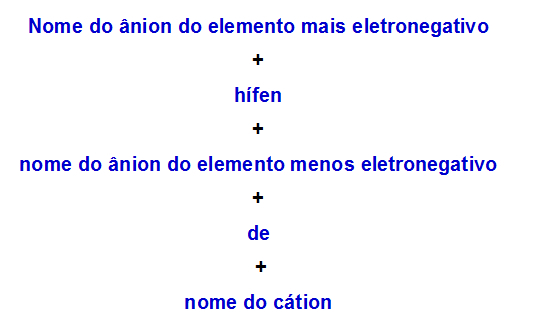
Pravidlo nomenklatury používané pro dvojné soli se dvěma anionty
Nepřestávejte... Po reklamě je toho víc;)
Zde jsou dva příklady použití tohoto pravidla:
1. příklad: MgFI
Tato sůl se skládá z:
Kation: hořčík (Mg+2);
Nejvíce elektronegativní anion: fluorid (F-1);
Méně elektronegativní anion: jodid (I.-1).
Proto se jmenuje fluorid-jodid hořečnatý.
2. příklad: ZnNO2br
Tato sůl se skládá z:
Kation: zinek (Zn+2);
Elektronegativnější anion: dusitan (NO2-1);
Méně elektronegativní anion: bromid (Br-1).
Proto se jmenuje nitrit-bromid zinečnatý.
Sestavení vzorce podvojné soli z jeho nomenklatury
a) Podvojná sůl se dvěma kationty
Konstrukce vzorce a podvojná sůl záleží na tom, zda znáte jeho název, který je standardizovaný jako ve všech solích, tj. nejprve kation a poté anion. Vzhledem k tomu, že podvojná sůl může mít dva kationty, jejich pořadí a umístění ve vzorci se řídí křestním jménem.
1. příklad: pyrofosforečnan barnatý nikl II
Tato sůl obsahuje fosfát (P2Ó7), baryum (Ba+2) a nikl II (Ni+2), kationty napsané v tomto pořadí. Takže jeho vzorec je BaNiP2Ó7.
2. příklad: fosforečnan měďnatý II a zlato I.
Tato sůl obsahuje fosfát (PO4-3), měď II (Cu+2) a zlato I (Au+1), kationty napsané v tomto pořadí. Proto je jeho vzorec CuAuPO4.
b) Podvojná sůl se dvěma anionty
V případě podvojná sůl se dvěma anionty se také řídíme, když umisťujeme anionty do vzorce, v pořadí, v jakém se objevují v daném jménu.
1. příklad: síran nikelnatý jodid III
Tato sůl má síranové anionty (SO4-2) a jodid (I-1), napsaný v tomto pořadí, a kationt niklu III (Ni+3). Takže jeho vzorec je NiSO4I.
2. příklad: kyanid fosforečnan olovnatý IV
Tato sůl má fosfátové anionty (PO4-3) a kyanid (CN-1), napsaný v tomto pořadí, a olověný kation IV (Pb+4). Takže jeho vzorec je PbPO4CN.
Podle mě. Diogo Lopes Dias
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
DNY, Diogo Lopes. „Co je to podvojná sůl?“; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-sal-duplo.htm. Zpřístupněno 28. června 2021.
Nomenklatura solí, klasifikace solí, název aniontu, název kationtu, síran železnatý, síran železnatý, dusičnan stříbra, chloridu draselného, chloridu sodného, chloridu vápenatého, dusičnanu stříbrného, síranu měďnatého, uhličitanu vápník.
Chemie

Každodenní soli, uhličitan vápenatý, chlorid sodný, fluorid sodný, dusičnan draselný, dusičnan sodný sodík, uhličitan sodný, hydrogenuhličitan sodný, hydrogenuhličitan sodný, siřičitan sodný, ledek, soda.
