je nazýván iontový paprsek velikost iontu. Studium této vlastnosti závisí na znalostech o atomovém poloměru a iontech.
Atomový poloměr: je míra velikosti neutrálního atomu (teoretická vzdálenost od jádra k poslední elektrosféře).
ionty: atomy, které ztrácejí (kationty) nebo získávají elektrony (anionty).
Protony uvnitř jádra a atom vyvíjet přitažlivou sílu na elektrony (negativní částice) přítomné v elektro sférách. Čím větší je počet protonů, tím větší je tato přitažlivost a naopak. Když se počet elektronů v atomu změní ztrátou nebo ziskem těchto částic, přitažlivost mezi protony a elektrony se změní takto:
V případě kationu:
Počet elektronů v elektrosférách je menší než počet protonů uvnitř jádra, což zvyšuje přitažlivou sílu jádra a přitahuje elektrony blíže k ní. elektrosféry. Výsledkem je zmenšení poloměru atomu. Poloměr kationtu bude tedy vždy menší než poloměr jeho neutrálního atomu.
Poloměr neutrálního atomu> Poloměr kationtu
V případě aniontu:
Počet elektronů v elektrosférách je větší než počet protonů uvnitř jádra. V tomto případě je přitažlivá síla vyvíjená jádrem překonána odpudivou silou mezi elektrony přítomnými v elektro sférách, což má za následek zvětšení poloměru atomu. Poloměr anionu bude tedy vždy větší než poloměr jeho neutrálního atomu.
Nepřestávejte... Po reklamě je toho víc;)
Poloměr anionu> Poloměr neutrálního atomu
Níže uvedené dvě situace jsou dobrým příkladem toho, co se stane s poloměrem iontu:
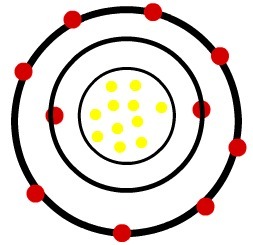
1) Neutrální atom sodíku (11Na) a kation sodný (11Na+)
Zatímco neutrální atom sodíku má jedenáct protonů (žluté koule) a jedenáct elektronů (červené koule), kation sodíku má jedenáct protonů a deset elektronů.

Model neutrálního atomu sodíku
Když neutrální atom sodíku ztratí elektron, poloměr se zmenší.
Model kationu sodíku
Pozorování: Třetí úroveň nebyla v obraze kationu zastoupena, protože protože ztratila jediný elektron, který měla, stala se prázdnou, a proto byla ignorována, ale je přítomna.
2.) Fosforový neutrální atom (15P) a kation fosforu (15P-3)
Zatímco atom neutrálního fosforu má patnáct protonů (žluté koule) a patnáct elektronů (červené koule), anion fosforu má patnáct protonů a osmnáct elektronů.
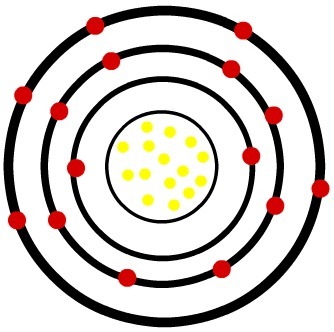
Model atomu neutrálního fosforu
Když atom neutrálního fosforu získá tři elektrony, poloměr se zvětší.
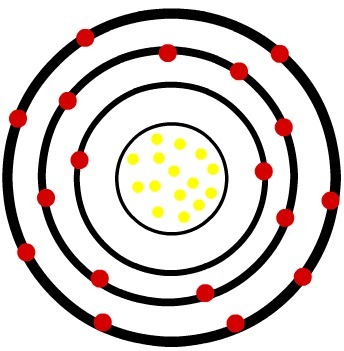
Model aniontu fosforu
Podle mě. Diogo Lopes Dias
Chcete odkazovat na tento text ve školní nebo akademické práci? Dívej se:
DNY, Diogo Lopes. "Iontový poloměr"; Brazilská škola. K dispozici v: https://brasilescola.uol.com.br/quimica/raio-ionico.htm. Zpřístupněno 28. června 2021.