Ve studiu termologie tomu říkáme adiabatické transformace ty plynné transformace, kde nedochází k výměně tepla s vnějším prostředím. Při adiabatické transformaci je tedy teplo nulové.
Q = 0
Pokud použijeme první zákon termodynamiky, máme:
Q = ∆U + τ
∆U = - τ
Co to ale znamená, že nedochází k výměně tepla mezi vnějším prostředím? To znamená, že pokud dojde k plynné expanzi a plyn provede práci 300 J, neudělá to pokud dojde k výměně tepla s médiem, bude změna vnitřní energie plynu záporná, proto budeme mít:
∆U = - 300 J
Nyní, pokud dojde ke snížení vnitřní energie plynu, můžeme říci, že došlo také ke snížení teploty plynu. Z obecného zákona o plynech

můžeme říci, že pokud se objem zvýší a teplota plynu se sníží, nutně se také sníží tlak plynu. Obecně lze říci, že totéž se děje s kompresí, protože pokud dojde ke kompresi, zvýší se vnitřní energie plynu, takže se zvýší také tlak.
Mind Map: Adiabatic Transformation
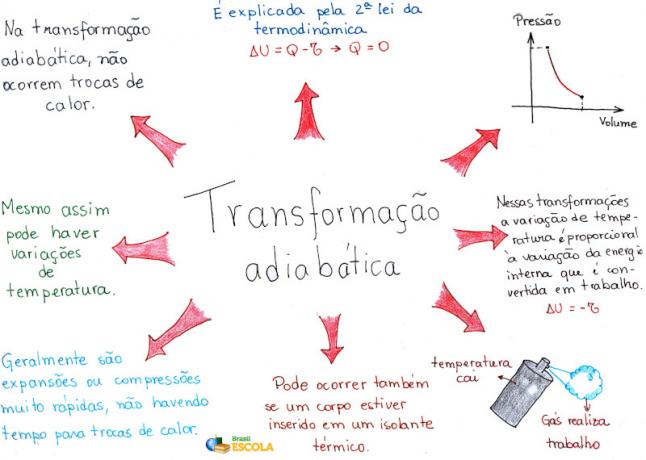
* Chcete-li stáhnout myšlenkovou mapu v PDF, Klikněte zde!
Krátce můžeme říci, že:
- při adiabatické expanzi, poklesu teploty a tlaku;
- při adiabatické kompresi se zvyšuje jak teplota, tak tlak.
Níže uvedený graf poskytuje přehled adiabatické transformace:
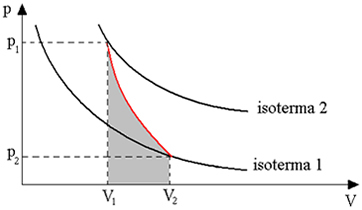
Adiabatické transformace se získávají pomocí tepelně izolovaných nádob nebo také kompresí nebo velmi rychlou expanzí.
Můžeme tedy dojít k závěru, že když si plyn vyměňuje teplo s vnějším prostředím, nějakou dobu trvá, než se teplo šíří plynnou hmotou a než se dostane do rovnováhy. Když se tedy provádí jak expanze, tak rychlá komprese, nedochází prakticky k žádné výměně tepla s externím médiem.
* Mind Map by Me. Rafael Helerbrock
Autor: Domitiano Marques
Vystudoval fyziku
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/fisica/estudo-transformacao-adiabatica.htm