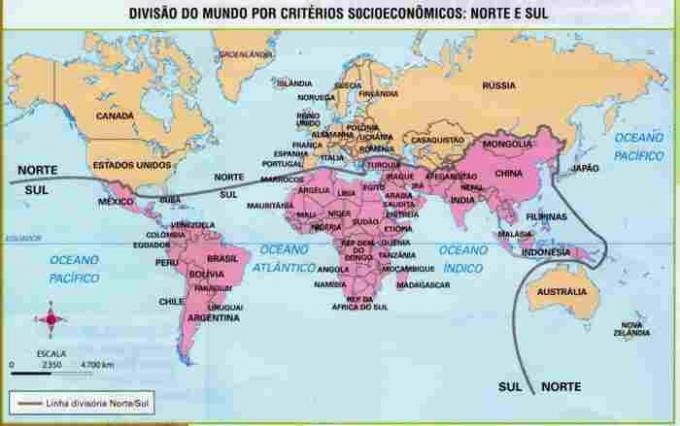
V adiční reakcev alkeny(uhlovodíky, které mají dvojnou vazbu mezi dvěma atomy uhlíku), je vazba pí mezi dvěma uhlíky přerušena a každý z uhlíků se váže na nový atom. Dívej se:
Obecný schematický model adiční reakce
Principy adiční reakce
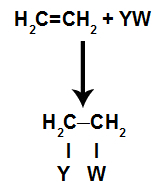
a) Rozbití pí spojení
Vazba pí se snadno rozbije, protože je slabší než vazba sigma. K tomu je však nutné, aby byl alken vystaven podmínkám, které toto narušení způsobují. Po přerušení vazby pí mezi dvěma uhlíky se na každém ze zúčastněných uhlíků vždy objeví vazebné místo (pro nové atomy).
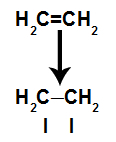
Schematické znázornění rozbití odkazu pi
b) Podmínky pro přerušení vazby pí
Faktory, které upřednostňují rozbití vazby pí, jsou:
Použití katalyzátorů;
Topení;
Přítomnost kyseliny v reakčním prostředí.
c) Výskyt adiční reakce
Vazebná místa vytvořená po přerušení vazby pi budou vždy obsazena atomy reaktantu, který je ve stejné nádobě jako alken. Adiční reakce je pojmenována podle typu činidla smíchaného s alkenem.
Typy adičních reakcí v Alkenes
a) Hydrogenace
Alken se smísí s plynným vodíkem (H
2) v nádobě a vystaven působení pevného katalyzátoru (nikl, platina nebo palladium) a zahřívání (Δ).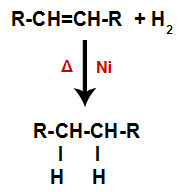
Obecné schéma hydrogenační reakce v alkenech
Přítomnost katalyzátoru a zahřívání způsobují vazbu pi alkenu a vazbu sigma mezi vodíky H2 být rozbit rychleji. S tím máme vytvoření dvou vazebných míst v alkenu a dvou volných atomů vodíku v reakčním médiu.

Vytvoření vazebných a separačních míst pro atomy
Okamžitě poté tedy každý volný atom vodíku zaujímá jedno z vazebných míst vytvořených v alkenu. Protože vytvořená látka má pouze uhlíky a vodíky, stejně jako jen jednoduché vazby mezi uhlíky, je to alkanu.
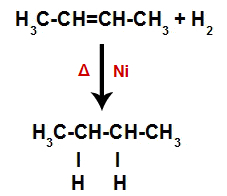
Rovnice představující tvorbu alkanu při hydrogenaci
B) Halogenace
Alken je smíchán s jednoduchými látkami (F2, Cl2, br2 Ahoj2) vytvořený halogeny (chlor, fluor, jod a brom) v nádobě a vystaveny působení světla (λ) a ohřevu (Δ).

Obecné schéma halogenační reakce v alkenech
Působením světla a ohřevu dochází k rychlejšímu rozbití vazby pí alkenu a vazby sigma mezi látkami tvořenými halogenem. S tímto máme vytvoření dvou vazebných míst v alkenu a dvou volných atomů halogenu v reakčním prostředí.

Vytvoření vazebných a separačních míst pro atomy
Okamžitě poté tedy každý volný atom halogenu zaujímá jedno z vazebných míst vytvořených v alkenu. Protože vytvořená látka má halogen vázaný na strukturu složenou z uhlíků a vodíku, je to a organický halogenid.

Rovnice představující tvorbu organického halogenidu při halogenaci
c) Hydratace
Alken se smísí s vodou (H2O) v nádobě a vystaven působení katalyzátoru (v tomto případě kyseliny sírové).
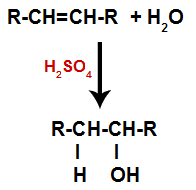
Obecné schéma hydratační reakce v alkenech
Přítomnost kyseliny sírové v reakci způsobí, že se pi vazba alkenu a sigma vazba mezi vodíkem (H) a hydroxylovou (OH) vodou rychleji rozbije. S tím máme vytvoření dvou vazebných míst v alkenu a jednoho volného vodíku a jednoho hydroxylu v reakčním prostředí.
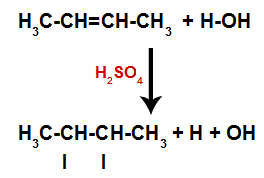
Vytvoření vazebných a separačních míst pro atomy
Krátce poté tedy vodík a hydroxylová skupina zaujímají jedno z vazebných míst vytvořených v alkenu. Protože vytvořená látka má hydroxylovou vazbu vázanou na nasycený uhlík (vytváří pouze jednoduché vazby), jedná se o alkohol.
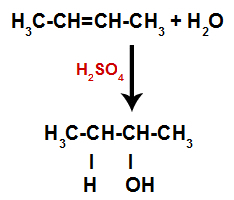
Rovnice představující tvorbu alkoholu při hydrataci
d) Přidání s halogenovodíky
Alken se smísí s halogenovanou anorganickou kyselinou (HF, HI, HCl, HBr) v nádobě.

Obecné schéma reakce halogenidu kyseliny v alkenech
Přítomnost kyseliny v reakci způsobí, že se pí vazba alkenu rychleji rozbije. Jednoduchá vazba v kyselině je přerušena, protože tyto látky přirozeně ionizují. V alkenu jsou tedy vytvořena dvě vazebná místa a v reakčním prostředí je přítomnost volného vodíku a halogenu.
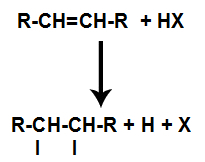
Vytvoření vazebných a separačních míst pro atomy
Krátce poté tedy vodík a halogen obsadí jedno z vazebných míst vytvořených v alkenu. Protože vytvořená látka má halogen vázaný na strukturu složenou z uhlíků a vodíku, jedná se o organický halogenid.
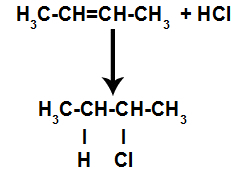
Rovnice představující tvorbu organického halogenidu při halogenaci
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/reacoes-adicao-alcenos.htm