THE teorie oktetů navrhl Newton Lewis, který ve studiích pozoroval, že dochází k atomové interakci takže každý prvek získá elektronickou stabilitu vzácného plynu, tj. osm elektronů v valenční vrstva. U některých molekul se však děje to, co se nazývá expanze nebo kontrakce oktetu, to znamená, že centrální atom vytváří více či méně předpokládané vazby.
Přečtěte si také: Kovalentní vazba - klasifikace a charakteristiky
Jak funguje teorie oktetu?
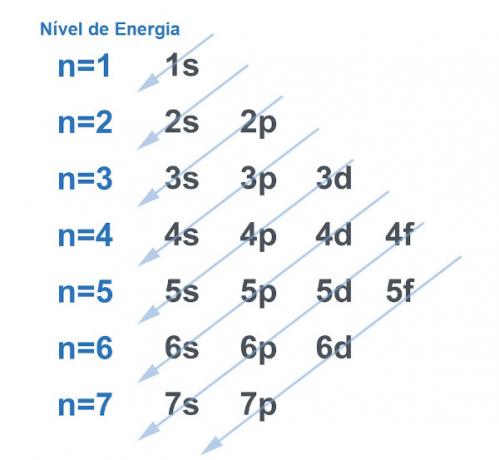
Samozřejmě všechny systémy mají tendenci hledat cestu získat co největší stabilitua u atomu se to nijak neliší. Atomy jsou „základní částice“ jakékoli hmoty a každý má ve své struktuře elektrosféru. Tato elektrosféra byla rozdělena na Linus Pauling v energetických úrovních a podúrovních. Pauling vytvořil diagram, který demonstroval, jak bude vypadat distribuce elektronů kolem jádra atomu.
Viz obrázek níže:

Každá úroveň a podúroveň obsahuje určité množství elektrony. Při analogii můžeme říci, že každá úroveň je policí a každá podúrovní je krabicí. Do každé krabice vložte dva elektrony. Atom je stabilní, když jsou spárovány všechny jeho elektrony, to znamená, když jsou všechny krabice se dvěma elektrony.
Příklad:
Udělejme elektronickou distribuci kyslíku (O), který má osm elektronů v přirozeném stavu.

Všimněte si, že ve valenční vrstvě (vrstvě L na podúrovni p) máme dva nepárové elektrony. Právě tyto elektrony vytvářejí chemické vazby s jinými prvky hledají vytvoření elektronických párů.
Teorie oktetu je založena na matematice sčítání elektronů. Pokud všechny podúrovně posledního elektronového obalu mají každý dva elektrony, valenční obal bude mít celkem osm elektronů a v důsledku toho bude atom stabilní.
Přečtěte si také: Kvantová čísla - čísla spojená s množstvím energie elektronu
vzácné plyny
Ušlechtilé plyny jsou jedinými prvky lze nalézt v přírodě v monoatomové formě, tj. bez navázání vazby s jiným atomem. Je to proto, že mají elektronickou stabilitu. Téměř všechny mají ve valenčním plášti osm elektronů., podřizující se pravidlu oktetu, s výjimkou plynného hélia, které má pouze dva elektrony.

Výjimky z teorie oktetu
Některé sloučeniny se stabilizují s více nebo méně než osmi elektrony ve valenčním plášti. V těchto případech dochází k výjimkám z teorie oktetů.
rozšíření oktetu
Stává se to hlavně u fosforu (P) a síry (S), které jsou relativně velkými atomy a mají podúrovň „d“. V tomto případě atom drží ve své poslední skořápce více než osm elektronů.
Příklad:

V případě fluoridu sírového zůstal centrální prvek s 12 elektronů, překračující 8 požadovaných ke stabilizaci podle pravidla oktetu. V tomto případě došlo k rozšíření oktetu.
oktetová kontrakce
Stává se s beryliem (Be), bórem (B) a některými oxidy dusíku. Viz příklad:

V případě fluoridu boritého získají atomy fluoru sdílením potřebných osm elektronů ve valenčním plášti elektronický s bórem, respektující oktetové pravidlo, ale centrální atom (bór) se nestabilizuje šesti elektrony, čímž dochází jeden kontrakce oktetu.
Také přístup: Klasifikace sigma odkazu: jaká jsou kritéria?
vyřešená cvičení
Otázka 1 - (Mackenzie-SP) Aby atomy síry a draslíku získaly elektronickou konfiguraci rovnající se konfiguraci vzácného plynu, je nutné, aby:
(Data: atomové číslo S = 16; K = 19.)
A) síra přijímá 2 elektrony a draslík přijímá 7 elektronů.
B) síra dává 6 elektronů a draslík přijímá 7 elektronů.
C) síra poskytuje 2 elektrony a draslík 1 elektron.
D) síra přijímá 6 elektronů a draslík se vzdává 1 elektronu.
E) síra přijímá 2 elektrony a draslík se vzdá 1 elektronu.
Řešení
Alternativa E. Síra je prvkem sloupce 16 nebo skupiny 6A. Prvky této rodiny mají tendenci přijímat dva elektrony za vzniku elektronických párů a mají celkem osm elektronů ve valenčním plášti. Prvky rodiny 1A, kterými jsou alkalické kovy, mají ve valenčním plášti pouze jeden elektron. Darováním tohoto elektronu se předchozí vrstva stane valenční vrstvou, již s osmi elektrony, jak to určuje pravidlo oktetu.
Otázka 2 - Posuzujte následující tvrzení jako pravdivá (T) nebo nepravdivá (F).
I () Pravidlo oktetu uvádí, že ve valenčním plášti je zapotřebí osm elektronů, aby byl atom stabilní.
II () Valenční vrstva je druhá elektronická vrstva atomu.
III () Chlor (Cl), z rodiny halogenů, má tendenci získávat dva elektrony, aby získal stabilitu.
IV () Sodík (Na), prvek rodiny 1A, má tendenci ztrácet jediný elektron ve své valenční skořápce.
Označte správnou alternativu:
A) I, III a IV jsou pravdivé.
B) I a IV jsou pravdivé.
C) Pouze II je pravda.
D) Falešná je pouze IV.
E) Všechny jsou pravdivé.
Řešení
Alternativa B. Já a IV jsou pravdivé. Výrok II je nesprávný, protože valenční vrstva je poslední elektronická vrstva atomu, nikoli druhá. A prohlášení III říká, že chlor má tendenci získávat dva elektrony, což nekontroluje, protože chlor pochází Rodina 7A nebo 17 má tendenci získávat pouze jeden elektron, aby tak získala elektronickou konfiguraci plynu ušlechtilý.
Autor: Laysa Bernardes Marques de Araújo
Učitel chemie