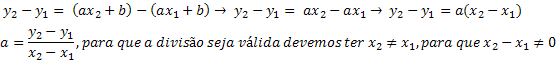Nitrosloučenina je organická sloučenina odvozená z chemické reakce mezi kyselinou dusičnou (HNO3) je to alkanu (nasycený uhlovodík s otevřeným řetězcem) nebo aromatický. Když kyselina dusičná reaguje s alkanem nebo aromatický, nastává substituční reakce, při které kyselina ztrácí hydroxylovou skupinu (OH) a organická sloučenina ztrácí vodík:
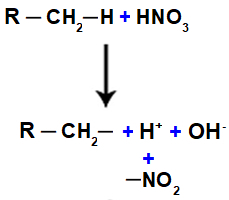
Dále máme tvorbu molekuly vody, která je výsledkem spojení mezi OH a H, zatímco ŽÁDNÁ skupina2 (který zbyl z kyseliny) se váže na alkan nebo aromatický a tvoří nitrosloučenina.
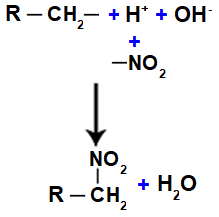
Znázornění tvorby vody a nitrosloučenin
Hlavní strukturální rys a nitrosloučenina je přítomnost jednoho nebo více nitroskupiny (NA2) spojené s alkanem nebo aromatem.
vlastnosti
S ohledem na vlastnosti fyzické, můžeme zdůraznit:
Obecně se jedná o viskózní kapaliny při pokojové teplotě (s výjimkou nitrosloučeniny nízké molární hmotnosti, což jsou tekuté kapaliny);
Mají vysoké teploty tání a varu;
Jsou hustší než voda;
Obecně jsou nerozpustné ve vodě, s výjimkou nitromethanu a nitroethanu;
Jsou-li tvořeny alifatickým řetězcem, mají příjemnou vůni a nejsou jedovaté. Nyní, pokud jsou tvořeny aromatickým řetězcem, jsou jedovaté a mají nepříjemnou vůni;
Ó typ mezimolekulární síly který spojuje své molekuly je permanentní dipól, protože mají polární charakteristiky.
Pokud jde o chemické vlastnosti, musíme vědět, že nitrosloučeniny jsou velmi reaktivní, to znamená, že se používají v různých organických reakcích, jako jsou substituční reakce.
Oficiální pravidlo nomenklatury navržené IUPAC (Mezinárodní unie pro čistou a aplikovanou chemii) pro nitrosloučeniny é:
Nitro + předpona + infix + o
Poznámka: Předpona souvisí s počtem uhlíků přítomných v řetězci nitrosloučenin. Infix souvisí s typem vazeb přítomných mezi uhlíky.
Příklady:
Názvosloví nitrosloučenin s normálním řetězcem

Zpočátku je zajímavé očíslovat řetězec nitrosloučenina (vždy z uhlíku nejblíže uhlíku, který má nitroskupinu):
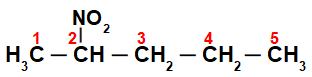
Číslováním řetězce řetězce nitrosloučenina, máme v něm pět atomů uhlíku (prefix pent), pouze jednoduché vazby mezi uhlíky (infix an) a nitroskupinou na uhlíku 2. Název této struktury je 2-nitropentan.
Názvosloví nitrosloučenin s normálním řetězcem
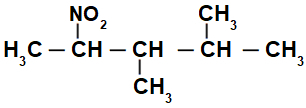
Strukturní vzorec rozvětvené nitrosloučeniny
Zpočátku je zajímavé očíslovat řetězec nitrosloučenina (vždy od uhlíku nejblíže uhlíku, který má nitroskupinu) na konec, který má nejvyšší počet uhlíků pro hlavní řetězec:
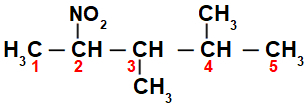
Číslováním řetězce řetězce nitrosloučenina, máme, že v něm je 5 atomů uhlíku (prefix pent), pouze jednoduché vazby mezi uhlíky (infix an), dva methylové radikály (na uhlíkových číslech 3 a 4) a nitroskupina na uhlíku 2. Název této struktury je 3,4-dimethyl-2-nitropentan.
Použití
Vy nitrosloučeniny, obecně je lze použít při výrobě pesticidů, barviv, anilinu, baktericidů, fungicidů, přísad, rozpouštědel; působí také jako výbušniny a při rafinaci ropy.
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-nitrocomposto.htm