Jeden adiční reakce je chemický proces, při kterém se atomy anorganické látky přidávají k organické molekule, která musí mít jednu z následujících charakteristik:
Otevřená struktura obsahující vazbu nebo pí odkazy;
Nasycená uzavřená struktura (pouze s sigma odkazy);
Uzavřená nenasycená struktura (s pí nebo aromatickou vazbou).
Organické sloučeniny, které mají tyto vlastnosti, jsou následující Uhlovodíky:
alkeny;
Alkyny;
Alkadienes;
Cyclans;
Cykly;
Aromatika.
Během a adiční reakce, jedna nebo více vazeb pí nebo vazba sigma (ve výlučném případě cyklánu) jsou přerušeny což způsobí, že se na zúčastněných uhlících objeví dvě nebo více volných valencí (vazebná místa), jako v příkladu níže:
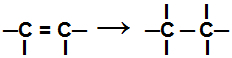
Přerušení vazby pí v alkenu
Po rozbití této vazby musí na nových vazebných místech vytvořených v organické sloučenině dojít k přidání atomů. Uvádíme níže typy adiční reakce které lze provést s organickými sloučeninami.
hydrogenace
V tomhle adiční reakce, kromě organické sloučeniny je dalším reaktantem plynný vodík (H2). V každém z uhlíků, kde dochází ke štěpení (rozbití vazby sigma nebo pi, jak je vidět výše), bude vazba atomu vodíku odkazující na množství rozbitých vazeb.
Když například provádíme hydrogenaci cyklobutanu, je mezi uhlíky 1 a 2 přerušena sigma vazba. Poté se atom vodíku váže na každý z těchto uhlíků:
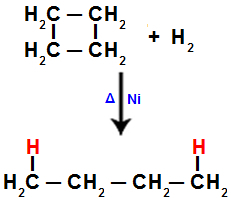
Rovnice představující hydrogenaci v cyklobutanu
Halogenace
Kromě organické sloučeniny je v tomto dalším činidlem adiční reakce je molekulární halogen (plynný chlor-Cl2, plynný fluor-F2, pevný jod-I2 a kapalný brom-Br2). Na každém uhlíku, kde dochází ke štěpení (rozbití vazby sigma nebo pi, jak je vidět výše), bude vazba atomu halogen s odkazem na počet přerušených připojení.
Když tedy provádíme halogenaci (pomocí plynného chloru) cyklopropenu, vazba pí se rozbije mezi uhlíky 1 a 2. Poté se atom chloru váže na každý z těchto uhlíků:

Rovnice představující halogenaci v cyklopropenu
Adiční reakce s halogenidem
Halogenid je anorganická hydra kyselina, tvořená atomem vodíku a atomem vodíku. halogen, jako je kyselina chlorovodíková (HCl), kyselina fluorovodíková (HF), kyselina bromovodíková (HBr), kyselina jodovodíková (HI).
Na adiční reakce s halogenidem je kromě organické sloučeniny dalším činidlem halogenid, tedy jeden z atomů uhlíku, kde štěpení (rozbití vazby sigma nebo pí, jak je vidět výše), musí přijímat atom vodíku a druhý přijímá halogenid.
Podle Markovnikovovo pravidlo, nejvíce hydrogenovaný atom uhlíku (nebo uhlík vázaný na menší radikál) musí přijímat vodík a méně hydrogenovaný uhlík (nebo uhlík vázaný na větší radikál) musí přijímat halogenid.
Například když provádíme tuto reakci na propenu s kyselinou chlorovodíkovou (HCl), vazba pi se rozbije mezi uhlíky 1 a 2. Poté se vodík váže na uhlík 1 (více hydrogenovaný) a chlor na uhlík 2 (méně hydrogenovaný):
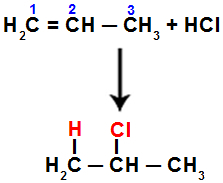
Rovnice představující přidání s halogenidem v propenu
Hydratační reakce
Molekula vody, když ionizuje, produkuje hydroniový kation (H+) a hydroxidový anion (OH-). Z tohoto důvodu v tomto adiční reakce, kromě organické sloučeniny je dalším reaktantem voda. Jeden z uhlíků, kde dochází ke štěpení (rozbití vazby sigma nebo pí, jak je vidět výše), tedy přijímá hydroniový kation a druhý přijímá hydroxidový anion.
Podle pravidla Markovnikova je nejvíce hydrogenovaný atom uhlíku (nebo uhlík vázaný na menší radikál) musí přijímat hydronium a méně hydrogenovaný uhlík (nebo uhlík vázaný na větší radikál) musí přijímat hydroxid.
Když například hydratujeme penta-1,4-dien, vazba pí se rozbije mezi uhlíky 1 a 2 a mezi uhlíky 4 a 5. Poté uhlíky 1 a 5 dostávají hydronium a uhlíky 2 a 4 hydroxid:
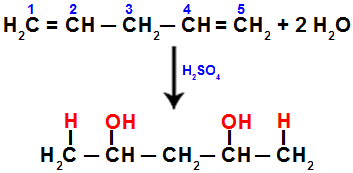
Rovnice představující přidání s hydratací v penta-1,4 dienu
Podle mě. Diogo Lopes Dias
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-reacao-adicao.htm

