Palivem používaným ve většině automobilů je benzín a ethanol. Úplným spalováním těchto dvou paliv vzniká oxid uhličitý (CO2 (g)) a voda (H2Ó). Bohužel však nedokonalé spalování a nečistoty přítomné v alkoholu a benzínu mohou generovat látky, které velmi znečišťují životní prostředí. V případě benzínu oxid uhelnatý (CO(G)); uhlovodíky (sloučeniny skládající se z uhlíku a vodíku), jako je ethan (C.2H6 (g)); a oxidy dusíku (NOX), zejména oxidu dusnatého (NO) a oxidu dusičitého (NO2 (g)).
Aby se zabránilo nárůstu znečištění ovzduší, potřebují všechna auta vybavení tzv katalyzátor nebo katalyzátor, což je zařízení proti znečišťování, které má za úkol zpracovávat tyto plyny uvolňované spalovacím motorem a přeměňovat je na méně škodlivé plyny. Katalyzátory se pro tento účel používají také v některých průmyslových procesech.
Uvedené znečišťující plyny opouštějí motor a vstupují do katalyzátoru procházející jakýmsi „úlem“, jejichž články jsou obecně vyrobeny z keramického nebo kovového materiálu, který je potažen oxidem hlinitým (oxid hlinitý - Al
2Ó3). Tento voštinový tvar s malými kanály je důležitý, protože poskytuje velkou kontaktní plochu pro plyny, díky nimž reagují rychleji.Ale skutečným katalyzátorem je kov, který leží na povrchu oxidu hlinitého. Typickými použitými kovy jsou palladium, rhodium, platina nebo molybden. Tyto kovy můžete také smíchat a použít slitiny. Například v případě benzínu se obvykle používá slitina palladia a thoria; v případě ethanolu se používá jiná slitina palladia a molybdenu. Tyto kovy provádějí heterogenní katalýzu se znečišťujícími plyny.
heterogenní katalýza jedná se o typ reakce, při které katalyzátor tvoří s reaktanty (v tomto případě znečišťujícími plyny) vícefázový systém. Je to proto, že se katalyzátor adsorbuje, to znamená, že zadržuje molekuly reaktantů na svém povrchu, oslabuje jejich vazby a urychluje reakci.
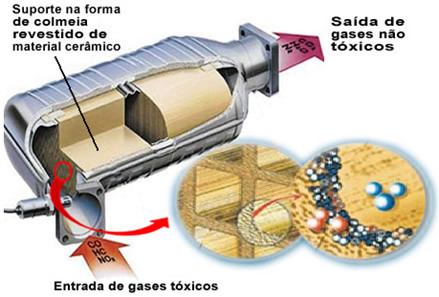
Kovy katalyzátoru tedy transformují znečišťující látky, jako jsou CO a NOX v netoxických plynech, jako je CO2, H2O, O2 a žádná2. Podívejte se na některé z těchto reakcí níže a všimněte si, že jimi dochází k oxidaci uhlovodíků a CO (odvozeno z nedokonalého spalování) a také redukce oxidů dusíku na plynný dusík (N2):
2 CO(G) + 2 NE(G) → 2 CO2 (g) + 1 N.2 (g)
2 CO(G) + 1 O.2 (g) → 2 CO2 (g)
2C2H6 (g) + 7 O.2 (g) → 4 CO2 (g) + 6 hodin2Ó(proti)
2 NE2 (g) +4 CO(G) → 1 s2 (g) + 4 CO2 (g)
2 NE2 (g) → 1 s2 (g) + 2 O.2 (g)
2 NE(G) → 1 s2 (g) + 1 O.2 (g)
Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/conversor-catalitico.htm
