Kovalentní vazba nastává, když dva atomy sdílejí páry elektronů, aby získaly elektronovou konfiguraci ušlechtilý plyn (s 8 elektrony ve valenčním plášti nebo s 2, v případě těch, které mají pouze K pláště), podle pravidla oktet.
Existují však speciální případy kovalentních vazeb sdílený elektronový pár pochází pouze z jednoho z atomů, který je již stabilní. Dříve byl tento typ kovalentní vazby nazýván dativ, dnes se běžněji nazývá koordinovat.
Podívejte se na několik příkladů, abyste pochopili, jak k tomu dochází:
- CO (oxid uhelnatý):
Uhlík má ve své valenční skořápce 4 elektrony. Aby bylo stabilní, musí podle pravidla oktetu přijímat další 4 elektrony, celkem 8. Kyslík má na druhé straně 6 elektronů ve valenčním plášti a potřebuje získat 2 elektrony, aby získal konfiguraci neonového vzácného plynu.
Nejprve tedy uhlík a kyslík sdílejí dva páry elektronů, takže kyslík je stabilní:
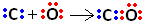
Uhlík však zůstává nestabilní, protože má stále 6 elektronů a potřebuje 2. Proto kyslík, který je již stabilní, sdílí jeden ze svých párů elektronů s uhlíkem, to znamená, že s ním vytváří dativní vazbu, čímž je stabilní:

Všimněte si, že kovalentní vazba souřadnic může být reprezentována pomlčkou, stejně jako běžná kovalentní vazba.
- POUZE2 (Oxid siřičitý):
Každý atom síry a kyslíku má ve svých valenčních skořápkách 6 elektronů, takže musí přijímat každý 2 elektrony. Zpočátku síra vytváří dvě společné kovalentní vazby, které sdílejí dva páry elektronů s jedním z atomů kyslíku, přičemž oba zůstávají stabilní s 8 elektrony.
Druhý atom kyslíku však není stabilní, takže s ním síra sdílí pár svých elektronů prostřednictvím koordinované nebo dativní kovalentní vazby:
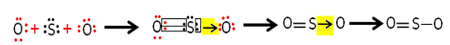
Všimněte si, že v tomto případě máme v molekule tři atomy, takže může dojít k migraci vazby z jednoho atomu na druhý. Molekula oxidu siřičitého může být také reprezentována takto: O ─ S ═ O.
Tento fenomén spojování nazýváme rezonance. Podívejte se na další tři příklady v tabulce níže:
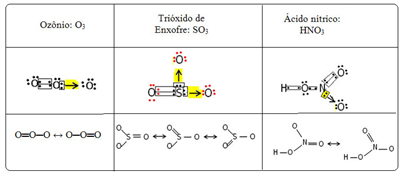
Možné struktury se nazývají rezonanční struktury nebo kanonické formy.
K tomuto typu vazby dochází také při tvorbě iontů, jako v případě hydroniových iontů (H3Ó+) a amonný (NH4+).
Nejprve kation H+ tvoří se, když vodík ztrácí svůj jediný elektron a zanechává v něm kladný náboj. Aby byla stabilní, bude muset přijmout dva elektrony. To se děje prostřednictvím dativní vazby s vodou (v případě hydroniového iontu) a s amoniakem (v případě amonného iontu). Hodinky:

Autor: Jennifer Fogaça
Vystudoval chemii
Zdroj: Brazilská škola - https://brasilescola.uol.com.br/quimica/ligacao-covalente-dativa-ou-coordenada.htm
